|
garantuje
Společnost infekčního lékařství ČLS JEP
Společnost pro epidemiologii a mikrobiologii ČLS JEP
Společnost pro lékařskou mikrobiologii ČLS JEP
Autoři:
| Prof. MUDr. Jiří Beneš, CSc. |
Univerzita Karlova v Praze, 3. lékařská fakulta, Klinika infekčních nemocí, Nemocnice Na Bulovce, Praha |
| Prof. MUDr. Petr Husa, CSc. |
Klinika infekčních chorob, LF MU a FN Brno-Bohunice |
| MUDr. Otakar Nyč, Ph.D. |
Ústav lékařské mikrobiologie, 2. LF UK a FN Motol, Praha |
| MUDr. Sylvia Polívková, Ph.D. |
Univerzita Karlova v Praze, 3. lékařská fakulta, Klinika infekčních nemocí, Nemocnice Na Bulovce, Praha |
Datum vydání: červen 2014
Souhrn
Kolitida vyvolaná Clostridium difficile je infekční choroba různé závažnosti, která může probíhat jako banální průjmové onemocnění, ale také jako život-ohrožující nemoc provázená paralytickým ileem a bolestivým rozepnutím tračníku, přecházející do sekundární sepse (toxické megakolon). Jiným možným projevem této choroby je rekurentní kolitida s opakovanými atakami průjmů, která postiženého jedince vysiluje fyzicky i psychicky.
Pro stanovení etiologické diagnózy se doporučuje vyšetřit stolici pacienta kombinací dvou až tří mikrobiologických metod (průkaz klostridiových toxinů A a B, průkaz klostridiové glutamátdehydrogenázy, průkaz mikroba anaerobní kultivací, případně průkaz genů kódujících tvorbu toxinů A a B). Další možnou cestou k stanovení diagnózy je endoskopické vyšetření s nálezem charakteristických ostrůvkovitých pablán na sliznici tračníku.
Volba léčby závisí na závažnosti nemoci a na pravděpodobnosti rekurence. Základními léky v terapii klostridiové kolitidy jsou metronidazol, vankomycin a fidaxomicin. Při opakovaných rekurencích se osvědčila transplantace stolice.
Výskyt klostridiové kolitidy ve zdravotnickém zařízení vyžaduje jednak zavedení izolačního režimu u nemocného jedince po dobu trvání průjmů, jednak uplatnění zásad surveillance a navazujících opatření, t.j. aktivní vyhledávání, včasnou léčbu postižených a prevenci šíření nákazy na další osoby. Při vyšším výskytu nemoci na oddělení je nutné revidovat preskripci antibiotik.
Klíčová slova
Clostridium difficile, post-antibiotická kolitida, metronidazol, vankomycin, fidaxomicin, transplantace stolice
Summary
Clostridium difficile infection (CDI) is a disease of various severity, manifesting itself from mild diarrhea to life-threatening paralytic ileus, painful distension of the large bowel, and sepsis. The other possible manifestation of the disease is recurrent colitis that can exhaust the patient.
For establishing the diagnosis, the patient ´s stool should be examined with two or three different microbiological methods (testing for clostridial toxins A and B; testing for clostridial glutamatdehydrogenase, anaerobic cultivation with specific media, or PCR detection of genes for production of clostridial toxins. The alternative way to assessing the etiology is coloscopic examination; the disease is ascertained if typical pseudomembrane isles are present in the bowel mucosa.
Optimal treatment depends on severity of the disease and on the risk of recurrence. Metronidazol, vancomycin and fidaxomicin are used as basic drugs. Faecal transplantation is effective in recurrent course of the disease.
In the hospital setting, patients suffering from CDI should be isolated for the whole period of diarrhea. Surveillance rules also should be applied, together with early treatment of symptomatic patients and prevention of speading the infection. Higher incidence of CDI in a ward implies that revision of the local antibiotic prescription habits should be performed.
Keywords
Clostridium difficile, post-antibiotic colitis, metronidazol, vancomycin, fidaxomicin, feacal transplantation
Definice
Kolitida vyvolaná C. difficile: Tato choroba patří do skupiny střevních infekcí, vykazuje však některé zvláštnosti v patogenezi onemocnění, v klinických projevech a výskytu komplikací a také v terapii.
Původcem nemoci jsou toxigenní kmeny bakterie Clostridium difficile. Tato bakterie se vyznačuje přirozenou rezistencí vůči mnoha běžně používaným antibiotikům. Její další významnou vlastností je tvorba vysoce odolných spór. Poškození tračníku způsobené klostridiovými toxiny může vést k letálnímu zakončení; další obávanou komplikací jsou relapsy či rekurence, které se mohou vícekrát opakovat až do úplného vysílení pacienta. Onemocnění je potenciálně nakažlivé a je nejvýznamnější příčinou průjmů v nemocničním prostředí.
V novější anglickojazyčné literatuře se nemoc označuje jako Clostridium difficile infection (CDI); tohoto akronymu se držíme i v tomto textu. Před rokem 2000 se používal spíše termín Clostridium difficile-associated disease nebo Clostridium difficile-associated diarrhea (CDAD). V běžné praxi se pro tuto nemoc užívají i další názvy, které však nejsou obsahově totožné a nemohou tedy být považovány za synonyma:
Post-antibiotická kolitida je střevní dysmikrobie vzniklá v důsledku předchozí antibiotické léčby. C. difficile bývá častým původcem toho typu kolitid, není však původcem jediným – podobný klinický obraz mohou vyvolat kvasinky rodu Candida nebo i jiné patogeny. Naopak kolitida způsobená C. difficile může vzniknout i z jiných příčin, například po podání cytostatik.
Pseudomembranózní kolitida označuje onemocnění charakterizované rozvojem pablán na sliznici tračníku. Pablány mohou být prokázány endoskopickým vyšetřením nebo jsou patrné prostým okem při operaci či pitvě. Nález ostrůvkovitých pablán se považuje za patognomický pro klostridiovou kolitidu (viz Diagnostika), nicméně tento obraz je vázán na stadium plně rozvinutého onemocnění a nemusí být přítomen u každého případu klostridiové kolitidy. Platí také, že přítomnost pablán na střevní sliznici může mít jiný původ než klostridiovou infekci (difterická kolitida).
Původce onemocnění
Clostridium difficile je grampozitivní sporulující bakterie vyskytující se běžně v přírodě, odpadních i povrchových vodách a také v trávicím traktu zvířat i lidí. Toxigenní kmeny produkují toxiny A (enterotoxin) a B (cytotoxin), které jsou považovány za hlavní faktory virulence. Většina patogenních kmenů tvoří také binární toxin, jehož mechanismus účinku dosud není znám. Nicméně epidemiologické studie prokázaly, že tvorba binárního toxinu je spojena s těžším průběhem nemoci. Malé procento kmenů C. difficile tvoří pouze toxin B, přičemž jejich infekční potenciál je zachován. Naopak ty bakterie, které prokazatelně neprodukují žádný toxin, nepředstavují ohrožení ani pro vnímavé jedince.
Epidemiologie
C. difficile patří v současnosti mezi významné původce nozokomiálních infekcí. Pravděpodobnost kolonizace nemocničních pacientů narůstá s délkou hospitalizace a je závislá na lokální epidemiologické situaci. Zatím nepotvrzeným, ale dosti pravděpodobným zdrojem kolonizace a možné infekce v komunitě mohou být domácí zvířata, případně některé masné produkty. Vysoké procento kolonizace (>50%) C. difficile se uvádí u dětí v prvních několika měsících po narození, i když prokazatelné infekce se u této skupiny vyskytují jen vzácně.
Zvýšená morbidita a mortalita související s výskytem CDI byla zaznamenána na přelomu tisíciletí v severní Americe a následně byl obdobný fenomén registrován v mnoha dalších oblastech na celém světě. Při pátrání po příčině zvýšené frekvence a závažnosti CDI byl identifikován hypervirulentní PCR ribotyp 027, charakterizovaný mimo jiné extrémně vysokou produkcí toxinů A i B. Další zkušenosti a analýzy ukázaly, že ribotypů s podobnými vlastnostmi existuje více. V UK se například často vyskytuje ribotyp 106, v Holandsku ribotyp 078, v asijských zemích byl popsán epidemický výskyt závažných forem CDI v návaznosti na ribotyp 017.
V České republice se uplatňuje, zejména u těžkých forem CDI, ribotyp 176. Tento ribotyp je někdy označován jako 027-like, protože se ribotypu 027 velmi podobá svými molekulárně genetickými charakteristikami i biologickými vlastnostmi. Recentní analýza kmenů C. difficile zaslaných z 11 mikrobiologických pracovišť v ČR prokázala, že ribotyp 176 tvoří 40 % ze všech izolátů. Dá se předpokládat, že tak vysoký podíl tohoto ribotypu je způsoben především nozokomiálním přenosem.
Patogeneze nemoci
Dispozice: Faktory podporující rozvoj CDI jsou shromážděny v tabulce 1. Nejvýznamnějším vyvolávajícím faktorem je střevní dysmikrobie, způsobená antibiotickou léčbou. Rozvoj kolitidy byl popsán po různých antibioticích, nejčastěji po podávání potencovaných i nepotencovaných aminopenicilinů, cefalosporinů všech generací, linkosamidů a fluorochinolonů. Doba potřebná k vyvolání CDI činí několik dní až týdnů; byl popsán vznik klostridiové kolitidy i po jediné dávce antibiotik. Onemocnění se může objevit během antibiotické léčby až několik týdnů po jejím skončení.
Vznik nemoci: C. difficile nepatří mezi invazivní patogeny, zpočátku jen adheruje na stěnu tračníku. Jedná-li se o toxigenní kmen, který produkuje toxiny A i B, pak tyto toxiny působí synergicky a v okolí mikrobiální kolonie poškozují jak střevní epitel, tak i hlubší vrstvy střevní stěny. Vznik průjmu v tomto iniciálním stadiu představuje samočistící mechanismus a je pro nemocného prospěšný. Naopak chabá peristaltika nebo podání léků tlumících střevní motilitu jsou faktory, které podporují rozvoj nemoci. Vznikají ostrůvkovité ulcerace a jejich povrch se pokrývá pablánami. Působením toxinu B na hladkou svalovinu a vegetativní nervy ve stěně tračníku dojde postupně k zástavě peristaltiky a rozvoji ileu, což dále podporuje množení mikrobů. Terminální stadium nemoci se vyznačuje enormním roztažením tračníku (megakolon) a postupnou ztrátou bariérové funkce střevní sliznice, takže různé střevní bakterie mohou pronikat do hlubších tkání. Rychle se rozvíjí sepse s vysokou smrtností.
Význam imunity: Po přemnožení klostridií ve střevě může organismus před závažným průběhem nemoci ochránit přítomnost slizničních protilátek proti toxinům A a B.
Rekurence: Dokud se neobnoví fyziologický střevní mikrobiální ekosystém, zůstává organismus vysoce vnímavý k opětovnému přemnožení klostridií a tedy nové atace nemoci.U těchto rekurencí lze někdy rozlišit relaps (opětovné vzplanutí infekce z klostridií nebo jejich spór, které zůstaly ve střevním traktu) od reinfekce (nová infekce způsobená spórami klostridií z vnějšího prostředí; přičemž se může jednat o stejný nebo jiný kmen). Předpokládá se, že reinfekce jsou častější než relapsy, protože nemocný s klostridiovou kolitidou vylučuje milióny spór v každém mililitru průjmové stolice a kontaminuje jimi své okolí. Infekční dávka u vnímavého jedince se pohybuje v řádu desítek až stovek spór. K opětovnému rozvoji infekce proto u disponovaných osob dochází velmi snadno. Je důležité si uvědomit, že příčinou rekurencí není selhání poskytnuté antibiotické léčby v důsledku rezistence.
Tabulka 1: Faktory disponující k vzniku klostridiové kolitidy (C. difficile)
| Disponující faktor |
Typické příklady |
| střevní dysmikrobie |
antibiotická léčba (zejména aminopeniciliny včetně kombinovaných přípravků obsahujících inhibitory beta-laktamáz, cefalosporiny 2. a 3. generace, klindamycin a ciprofloxacin) |
| porucha slizniční imunity v GIT |
nedostatečná tvorba slizničních IgA; karence bílkovin; maligní tumory; léčba cytostatiky; idiopatická zánětlivá onemocnění střeva (ulcerózní kolitida, Crohnova choroba) |
| imobilita střeva |
stavy po operaci v břišní dutině; podávání léků tlumících peristaltiku; gravidita |
| celková imobilita |
dlouhodobý pobyt na lůžku; operace v celkové narkóze; revmatické a nervové choroby omezující hybnost |
| hospitalizace |
zejména pobyt na JIP; riziko infekce je vyšší na odděleních, kde se již klostridiová kolitida v minulosti vyskytla |
| vyšší věk |
incidence a závažnost nemoci podstatně narůstá od věku ≥65 let |
Klinický obraz
Kolitida způsobená C. difficile u mladších osob bez alterace celkového stavu většinou vzniká jako důsledek předchozí antibiotické léčby a projevuje se jako akutní průjmové onemocnění, které může, ale nemusí být provázeno horečkami a zvracením. Průjmy u klostridiové kolitidy nebývají profúzní, stolice jsou četné, někdy páchnoucí, ale ne objemné. U pacientů upoutaných na lůžko (např. po operaci) může tento stav imponovat jako náhle vzniklá inkontinence stolice.
Závažnější formy nemoci jsou provázeny bolestmi břicha, meteorismem a postupným oslabování střevní peristaltiky až k rozvoji ileu. U starších pacientů může být tento stav provázen narůstající apatií a kvantitativní poruchou vědomí. Horečka může, ale nemusí být přítomna. Laboratorně bývá často zjišťována nápadná leukocytóza, která kontrastuje s jen málo zvýšenou hladinou CRP.
Podezření na klostridiovou kolitidu by mělo být vysloveno zejména v následujících situacích:
- akutní průjmové onemocnění vzniklé u osob užívajících antibiotika (nebo do 2 týdnů po antibiotické kúře);
- akutní průjmové onemocnění provázené nápadným meteorismem, subileózním stavem, bolestmi břicha a/nebo leukocytózou, přičemž chirurg vyloučil náhlou břišní příhodu;
- akutní průjmové onemocnění vzniklé v nemocnici, zejména v případech, kdy jde o starší a imobilní osoby a/nebo na daném oddělení se toto onemocnění vyskytlo již v minulosti;
- subileus nebo ileus u nemocného s disponujícími faktory popsanými v tabulce 1.
Těžký průběh nemoci je definován jako přítomnost alespoň jednoho z příznaků uvedených v tabulce 2.
Toxické megakolon je nejtěžší formou klostridiové kolitidy. Je charakterizováno rozvojem paralytického ileu a enormní dilataci kliček tlustého a posléze i tenkého střeva. Pacient je v této fázi bezprostředně ohrožen na životě, smrtnost činí 30-80 %.
Rekurence mohou mít lehčí, ale i těžší průběh než předchozí ataka. Obvykle k nim dochází do 2 měsíců od předchozí ataky. Po první atace se pravděpodobnost rekurence pohybuje v rozmezí 15-25 %. Objevila-li se druhá ataka, dosahuje pravděpodobnost další rekurence 40-65 %. Byly popsány i případy s více než dvaceti rekurencemi. Pacient s opakovanými atakami klostridiové kolitidy je ohrožený dehydratací, minerálovým rozvratem, malnutricí a celkovým fyzickým i psychickým vyčerpáním.
Opakované rekurence zpravidla nemocné velmi vyčerpávají, zejména jde-li o starší nebo polymorbidní jedince. Vedle toxického megakolon jsou opakované rekurence druhou významnou příčinou úmrtí na klostridiovou infekci.
Tabulka 2: Příznaky svědčící pro těžký průběh klostridiové kolitidy (C. difficile)
- horečka >38,5 °C
- zimnice a třesavky
- hemodynamická nestabilita včetně septického šoku
- známky peritonitidy
- paralytický ileus
- leukocytóza >15 x 109/l
- posun doleva (>20 % tyčí v diferenciálu leukocytů)
- vzestup kreatininu v séru (>50 % nad obvyklou hodnotu)
- vzestup hladiny laktátu v séru
- pseudomembranózní kolitida zjištěná koloskopicky
- rozpětí tračníku (>80 mm v oblasti céka nebo >60 mm na transverzu a descendentu) prokázané zobrazovacím vyšetřením (rtg nativ břicha, CT)
|
Pozn.: Pacienti ve věku ≥65 let, se závažnými komorbiditami a/nebo se závažnou poruchou imunity mají být léčeni ve stejném režimu jako nemocní s těžkým průběhem klostridiové kolitidy. Totéž platí pro pacienty přijaté na JIP.
Diagnostika
Mikrobiologické vyšetření stolice cílené na průkaz C. difficile je indikováno u pacientů s klinickým podezřením na CDI. Není indikováno u jedinců s formovanou stolicí a běžně se neprovádí ani u dětí do 2 let věku.
Pro mikrobiologické vyšetření v případě podezření na CDI je třeba odebrat minimálně 2 ml stolice do sterilní nádobky. Optimálně by měl být vzorek vyšetřen do dvou hodin po odběru; tento požadavek se týká hlavně průkazu toxinů imunochemickou metodou, neboť toxiny nejsou stabilní a opožděné vyšetření může způsobit falešnou negativitu výsledku.
Není-li možné vyšetřit stolici ihned, je třeba vzorek uchovat při chladničkové teplotě 5 °C. Pak by stabilita měla být zajištěna po dobu 48 hodin. Pro dlouhodobé zachování aktivity toxinů je nutné zmrazení na -70 °C.
Obecné zásady laboratorní diagnostiky: Vzhledem k rozdílné citlivosti různých metod je podle současných doporučení preferována kombinace dvou nebo více testů (tabulky 3 a 4). Smyslem kombinace metod je získaní co nejspolehlivějšího výsledku, tedy nejen vyloučení nebo potvrzení přítomnosti toxigenního kmene C. difficile, ale i posouzení klinické významnosti pozitivního nálezu. Příklad algoritmu kombinujícího různé metody včetně interpretace vycházející z aktuálních doporučení HPA (Health Protection Agency, UK) je uveden v tabulce 5.
Základní postup spočívá ve vyšetření stolice na přítomnost klostridiové glutamátdehydrogenázy (GDH) a současně i na přítomnost toxinů A a B. Principem všech těchto vyšetření je enzymoimunoesej (EIA). Průkaz glutamátdehydrogenázy je stále považován za optimální test pro vyřazení C. difficile-negativních vzorků. Je-li průkaz GDH pozitivní a test na přítomnost toxinů vychází negativní, považuje se onemocnění za suspektní CDI. Pro potvrzení klostridiové etiologie se provádí konfirmační vyšetření – kultivace stolice cílené na klostridia anebo PCR. Další alternativu představuje koloskopické vyšetření (viz níže).
Kultivace stolice na průkaz C. difficile se má provádět u všech nemocných, kde průkaz GDH a toxinů nepřinesl jasný výsledek, a rovněž u pacientů s těžkým průběhem CDI. Dalším možným důvodem pro založení kultivace je snaha o ověření citlivosti konkrétního kmene C. difficile k antibiotikům nebo získání podkladů pro epidemiologické šetření (surveillance). Pro účely surveillance je obvykle nutné provádět ribotypizaci izolovaných kmenů; toto vyšetření zajišťuje specializované pracoviště (Ústav klinické mikrobiologie, FN Motol, Praha 5).
PCR vyšetření (průkaz genu kódujícího syntézu toxinu B a případně i toxinu A) slouží obvykle jako konfirmační metoda. Je-li naopak toto vyšetření použito jako vyhledávací test, měla by být klinická významnost pozitivní výsledku potvrzena detekcí toxinů metodou EIA.
Post-analytická fáze: Pozitivní nálezy, tedy průkaz toxigenního kmene C. difficile, je třeba neprodleně hlásit na oddělení, kde je pacient hospitalizován. Podobně je nutné neprodleně oznámit klinickému lékaři pozitivitu GDH, a to i v případě, že je průkaz toxinů imunochemickou metodou negativní a je třeba doplňujících vyšetření.
Konečnou interpretaci laboratorních nálezů je třeba vždy vztáhnout ke konkrétnímu pacientovi, jeho klinickému stavu a dalším laboratorním výsledkům, případně aktuální epidemiologické situaci.
Tabulka 3: Principy laboratorních metod k průkazu C. difficile ve stolici
| Průkaz cytotoxicity na tkáňových kulturách a neutralizační test |
Metoda je považována za zlatý standard, jedná se ale o specializované vyšetření náročné na laboratorní vybavení, které mimo jiné vyžaduje také interpretační zkušenost. Je tedy vyhrazena specializovaným a referenčním pracovištím. |
| Imunochemický průkaz toxinů A a B |
Nejjednodušší, nejlépe dostupná a rychlá metoda. Je doporučeno vyšetřovat oba toxiny, A i B. K dispozici je řada komerčních kitů. Principem průkazu může být enzymoimunoesej (EIA) s obecně vyšší citlivostí nebo imunochromatografie. |
| Průkaz glutamátdehydrogenázy |
Glutamátdehydrogenáza (GDH) je exoenzym, který charakteristicky tvoří C. difficile. GDH může být stanovena samostatně nebo je součástí testů prokazujících zároveň i toxiny. Metoda průkazu je stejná jako v předchozím případě (EIA). |
| Kultivace |
Vzorek určený ke kultivaci je nutné inkubovat s 96% etanolem nebo 70% metylalkoholem (ana partes), zhruba hodinu před naočkováním. Tento postup významně zvyšuje citlivost kultivace (alkohol stimuluje klíčení spór). K vlastní kultivaci lze použít širokou škálu základních i selektivních médií. Konfirmace kultivačního nálezu je možná biochemicky, hmotnostní spektrometrií ( MALDI – TOF), případně latex-aglutinačním testem. |
| PCR |
K dispozici jsou komerční kity: realtime PCR k průkazu genů pro tvorbu toxinu B, případně k detekci delecí charakteristických pro některé epidemické PCR ribotypy (027, 176 a další). |
Tabulka 4: Citlivost jednotlivých laboratorních metod používaných v diagnostice CDI
| Diagnostický test |
Trvání testu |
Citlivost |
Výhody |
Omezení |
| Anaerobní kultivace |
2-3 dny |
99-100 % |
Možnost další molekulární typizace, určení ATB citlivosti |
Primárně nerozliší toxické a netoxické kmeny, dlouhá doba nutná k průkazu |
| Průkaz cytopatického efektu (CPE) na tkáňových kulturách a neutralizační test |
2 dny |
94-100 % |
Zlatý standard, historický význam |
Riziko falešné pozitivity, náročnost provedení, dlouhá doba nutná k průkazu |
| Specifický antigen (glutamát dehydrogenáza) |
15-45 minut |
90-100 % |
Jednoduchost a rychlost testu. Vysoká NPV* |
Nerozliší toxigenní a netoxigenní kmeny, možnost zkřížené reakce s jinými anaeroby |
| EIA– průkaz toxinů A a B |
2 hod. |
60-80 % |
Jednoduchost a rychlost testu, průkaz toxinů. Vysoká PPV** |
Omezená citlivost |
| Real-time PCR (komerční sety) |
cca 60 min |
99-100 % |
Vysoká citlivost |
Neumožní rozlišení kolonizace od infekce |
*NPV – negativní prediktivní hodnota (Vysoká NPV znamená, že negativní výsledek s velkou spolehlivostí vylučuje možnost klostridiové infekce.)
**PPV – pozitivní prediktivní hodnota (Vysoká PPV znamená, že pozitivní výsledek s velkou spolehlivostí prokazuje klostridiovou infekci. U real-time PCR je hodnota PPV paradoxně snížená, protože metoda je natolik citlivá, že prokazuje i přítomnost malého množství toxigenních bakterií C. difficile, které se může vyskytnout při běžné kolonizaci.)
Tabulka 5: Příklad algoritmu při průkazu C. difficile ve stolici a interpretace nálezů
| Průkaz GDH nebo PCRa |
Průkaz toxinů A a B (EIA) |
Interpretace výsledků |
| pozitivní |
pozitivní |
Vysoká pravděpodobnost CDI. Pacienta nutno izolovat, léčit a hlásit jako CDI. |
| pozitivní |
negativní |
Suspektní CDI. Není-li známa jiná příčina obtíží, je doporučeno pacienta izolovat a léčit jako CDI. Pro potvrzení diagnózy je potřeba založit kultivaci stolice na C. difficile, případně provést koloskopii. |
| negativní |
pozitivní |
Pravděpodobně jde o laboratorní chybu. Je vhodné zopakovat vyšetření. |
| negativní |
negativní |
CDI laboratorně vyloučeno, nutno hledat jiný zdroj obtíží.
|
a GDH – glutamátdehydrogenáza; PCR – průkaz genů pro tvorbu toxinů A a B.
Endoskopická diagnostika
U nemocných se středně těžkou až těžkou formou CDI se na sliznici tračníku objevují ostůvkovité povláčky. Jejich velikost i hustota postupně narůstají, až nakonec může být sliznice pokryta pablánami v celém rozsahu. Endoskopický obraz klostridiové kolitidy je v období výskytu ostrůvkovitých pablán natolik charakteristický, že jeho nález se považuje za patognomonický a ekvivalentní mikrobiologickému průkazu CDI. Koloskopie tedy může sloužit jako konfirmační vyšetření v případě, když GDH je pozitivní a průkaz toxinů A a B negativní.
Je však potřeba mít na paměti limitace endoskopické diagnostiky: U některých vyšetřovaných osob (zvl. při mírně probíhajících onemocnění) nemusí být endoskopický nález jednoznačný. Pak je možné odebrat biopsii a počkat na histologické vyhodnocení, tím se však stanovení diagnózy oddaluje na dobu srovnatelnou s kultivačním vyšetřením. Popis koloskopického nálezu je subjektivní, zjištěný obraz se obvykle nezaznamenává, chybí tedy možnost dodatečné kontroly, zda popis odpovídal realitě. U pacientů s těžkým postižením střeva nelze pominout riziko perforace střeva při nešetrné manipulaci. Skutečný rozsah výše uvedených omezení záleží na zkušenostech endoskopisty a na kvalitě vybavení endoskopického pracoviště.
Význam zobrazovacích metod
Nativní rtg snímek břicha nebo CT vyšetření mohou prokázat dilataci střevních kliček a vyhlazení haustrace. Sonografie nebo CT ukáží zánětlivé rozšíření střevní stěny. Kromě toho na CT snímcích se po orálním nebo rektálním podání kontrastní látky mohou pablány na stěnách tračníku manifestovat jako defekty kontrastní náplně. Při současném intravenózním podání kontrastní látky je pro klostridiovou kolitidu typické, že se sytí bezprostřední okolí střevního lumen (sliznice a podslizniční vazivo), ale ne hlubší vrstvy střevní stěny.
Jmenované zobrazovací metody mohou významně podpořit podezření na CDI, samy o sobě však jejich výsledky nejsou považovány za průkazné.
Léčba
Volba léčebné strategie u CDI závisí na tíži onemocnění, věku pacienta a přítomných komorbiditách. Klinické a laboratorní parametry definující těžkou CDI jsou uvedeny v části doporučení věnující se klinickému obrazu onemocnění.
Obecná terapeutická doporučení
- Pokud je to možné, okamžitě se ukončuje antibiotická léčba, která vedla ke vzniku CDI. Podání specifické terapie namířené proti C. difficile v těchto případech není nezbytné; jde-li o lehkou formu CDI, může toto samotné opatření navodit úzdravu.
- Jestliže antibiotickou léčbu původního onemocnění nelze přerušit, je alespoň u některých nemocných možné nahradit dosud podávané antibiotikum jiným přípravkem s užším spektrem účinnosti a nižším potenciálem pro vyvolání CDI.
- Podle potřeby se pacientovi podává rehydratace a kolitická dieta (t.j. nenadýmavá a nedráždivá strava, bez jiných zvláštních omezení). U těžších případů je indikována parenterální výživa.
- Léky tlumící střevní peristaltiku (spasmolytika, opiáty) jsou kontraindikovány; po jejich podávání hrozí rozvoj toxického megakolon se zástavou peristaltiky a možností perforace střeva.
- Léky tlumící žaludeční aciditu jednoznačně přispívají ke vzniku CDI, není však jasné, zda ukončení této léčby příznivě ovlivňuje průběh již vzniklé CDI.
Terapeutické možnosti
Metronidazol je antibiotikum působící na většinu anaerobně rostoucích bakterií. Je běžně používaný a levný. Je to také jediné antibiotikum, které lze v léčbě CDI použít v orální i parenterální formě. Při orálním podání se metronidazol téměř dokonale vstřebává již v horních částech střevního traktu a přechází do krve. Do tračníku se dostává intestinální sekrecí. Z toho vyplývá, že účinek při parenterálním a orálním podání je prakticky identický. Nevýhodou metronidazolu je nižší účinnost ve srovnání s vankomycinem a fidaxomicinem, která se projevuje pozdějším nástupem úzdravy a také větším rizikem terapeutického selhání. Standardní dávkování metronidazolu je 500 mg každých 8 hodin, toto schéma platí pro tabletové i infuzní přípravky. Dávkování u dětí činí 5 mg/kg každých 6-8 hodin.
Vankomycin je záložní antibiotikum určené především k léčbě závažných infekcí vyvolaných gram-pozitivními bakteriemi. Vankomycin se nevstřebává z GIT, orální podání tedy není spojeno s rizikem orgánové toxicity. (V literatuře existuje několik kazuistik popisujících systémovou toxicitu po orálně podaném vankomycinu, jde však o zcela ojedinělé případy.) V ČR nejsou registrovány žádné tabletové přípravky obsahující vankomycin. Lék může být proto připraven přímo na oddělení rozpuštěním 500 mg prášku na přípravu infuze v 20 ml vody na injekci; vzniklý roztok pacient vypije ve čtyřech dávkách s odstupem vždy 6 hodin. Stabilita roztoku při uchování v chladničkové teplotě činí 48 hodin. Vankomycin k orální léčbě lze používat i ve formě kapslí, které z prášku vyrobí nemocniční lékárna. Tato forma se jeví jako výhodná zejména při pulzním podávání po propuštění z nemocnice; bohužel pojišťovny takový způsob léčby nehradí.
Standardní dávkování pro léčbu CDI činí 125 mg vankomycinu (1/4 obsahu lahvičky obsahující 500 mg antibiotika) po 6 hodinách. Toto množství za běžných podmínek vytvoří ve střevním obsahu koncentrace přesahující 150 mg/l, což převyšuje hodnoty MIC o dva řády. Zvýšené dávkování (250-500 mg po 6 hodinách) se používá jen v případech, kdy není zaručeno dobré promísení vankomycinu se střevním obsahem. Jde především o nemocné, u nicž se rozvinul ileus, takže antibiotikum musí být podáváno klysmaty, a případně i o pacienty s anatomickými deformitami tračníku, které znemožňují normální peristaltický pohyb střev (striktury po operaci, střevní divertikly).
Dětem se vankomycin p.o. podává v množství 15-40 mg/kg/den, rozděleně do 3-4 dávek.
Fidaxomicin je nové antibiotikum s úzkým spektrem, které je registrováno pouze pro léčbu CDI. Nevstřebává se z GIT, nemá tedy žádné systémové nežádoucí účinky. Inhibuje proteosyntézu na bakteriálních ribozomech, to znamená, že u C. difficile zastavuje syntézu toxinů. Účinek tohoto antibiotika je proto rychlejší než účinek metronidazolu i vankomycinu. Doporučené dávkování činí 1 tbl (200 mg) po 12 hodinách.
Tigecyclin je širokospektré parenterální antibiotikum tetracyklinové řady. Je účinný i na četné multirezistentní kmeny bakterií. Do střevního lumen se dostává intestinální sekrecí podobně jako metronidazol, způsob účinku spočívá v inhibici proteosyntézy bakterií, čímž připomíná fidaxomicin. Účinnost tigecyklinu v léčbě CDI zatím nebyla prověřena spolehlivými studiemi. Uplatnění tedy nachází jen v případech, kdy nelze použít standardní léčbu. Jde zejména o těžké případy klostridiové kolitidy spojené se zástavou peristaltiky, kde orálně podávané přípravky nemohou proniknout do ložiska infekce. Tigecyklin se podává 100 mg v úvodní infuzi, dále 50 mg i.v.inf. každých 12 hodin.
Teikoplanin je antibiotikum příbuzné vankomycinu. Vzhledem k vankomycinu má srovnatelnou účinnost, ale je dražší a obtížněji dostupný, proto v doporučených postupech není obsažen.
Rifaximin je antibiotikum příbuzné rifampicinu, s poměrně širokým spektrem účinku, které zahrnuje i C. difficile. Zatím není k dispozici dostatek informací o jeho účinnosti v léčbě CDI. V literatuře byla popsána rezistence některých kmenů C. difficile k rifaximinu, šlo zejména o epidemické ribotypy.
Probiotika nevykazovala prokazatelný efekt v léčbě CDI. Signifikantní přínos probiotické léčby byl zjištěn pouze při podávání přípravků obsahujících živé kvasinky Saccharomyces boulardii, na druhé straně při použití tohoto léku u imunokompromitovaných pacientů byl popsán rozvoj systémové mykotické infekce. Ani v profylaxi CDI nebyl efekt probiotik jednoznačně prokázán.
Intravenózně podaný roztok imunoglobulinů (IVIG) v dávce 150-400 mg/kg hmotnosti zlepšil průběh CDI v ojedinělých publikovaných kazuistikách. Zatím však přínos toho léku nebyl prokázán v kontrolovaných studiích.
Fekální bakterioterapie („transplantace stolice“) je založena na poznatku, že stolice zdravého jedince je až z 80 % tvořena intestinální mikroflórou. Poprvé byla popsána již v roce 1958 a od začátku tohoto tisíciletí zažívá renesanci v souvislosti s nárůstem výskytu rekurentních forem CDI. Před fekální bakterioterapií jsou pacienti léčeni 10-14 dní vankomycinem (125 mg 4× denně p.o.). Homogenizovaná stolice zdravého dárce je potom podána jednorázově nasojejunální sondou, čímž je snížen negativní vliv kyselé žaludeční šťávy na přežití mikrobů. Stejný význam má i podání inhibitoru protonové pumpy večer a ráno před bakterioterapií. Úspěšnost této terapie u rekurentních forem CDI je udávána různými autory ve více než v 80 % případů. Alternativně je možné podat dárcovskou stolici rektální cestou, buď vysokým klysmatem nebo s pomocí endoskopu do až céka. Spolehlivost tohoto postupu zatím není známa.
Kolektomie s terminální ileostomií je považována za ultimum refugium při rozvoji toxického megakolon. V léčbě CDI je rovněž indikována při perforaci tračníku. Dříve byla doporučována i při rozvoji ileu a při vzniku sepse s multiorgánovým selháním, která nereaguje na antibiotickou léčbu. Letalita urgentně provedené kolektomie pro komplikovaný průběh CDI je vysoká a pohybuje se mezi 19 % až 71 % v závislosti na klinickém stavu pacienta v době zákroku. Podle souhrnu literárních údajů je přesto letalita v souvislosti s chirugickým řešením komplikovaného průběhu CDI nižší než při pokračování medikamentózní terapie, která nadále nezlepšuje klinický stav pacienta. Několik studií prokázalo, že časné provedení kolektomie je spojeno s nižší mortalitou. Dle klinických studií jsou nezávislými rizikovými faktory mortality u pacientů podstupujících kolektomii šokový stav s nutností podání vazopresorů, vysoký sérový laktát (> 5 mmol/l), poruchy vědomí, selhání ledvin a jiných orgánů, potřeba intubace a arteficiální ventilace.
Do budoucna bude možná představovat alternativu ke kolektomii derivační axiální ileostomie. Střevo se potom v aborálním i orálním směru proplachuje roztokem obsahujícím vankomycin. Současně je možno podávat metronidazol nebo tigecyklin intravenózní cestou. Názory na indikaci a optimální způsob provedení operace zatím nejsou ustálené. V době přípravy tohoto doporučeného postupu probíhá multicentrická studie, která má tento způsob léčby prověřit.
Poznámka: Ve výčtu terapeutických možnosti nejsou uvedeny přípravky, které se používají v jiných zemích, ale nejsou registrovány v ČR (nitazoxanid, kyselina fusidová) nebo jsou teprve ve vývoji (monoklonální imunoglobuliny proti toxinům C. difficile, ramoplanin).
Standardní medikamentózní léčba (v souladu s novými Doporučenými postupy EU)
Léčebný postup závisí na tom, zda jde o primoinfekci anebo recidivu CDI, dále na závažnosti nemoci a funkčním stavu GIT. Podle toho je definováno několik variant léčby (viz Obr. 1).
U jednotlivých léčebných variant uvádíme sílu důkazů podporujících příslušný postup. Při hodnocení byla použita následující škála:
- A – silné, jednoznačné doporučení
- B – středně silné doporučení
- C – slabé doporučení
- D – silně nedoporučeno
- I – tvrzení je podepřeno aspoň jednou kvalitní randomizovanou kontrolovanou studií
- II – tvrzení je podepřeno aspoň jednou kvalitní klinickou nerandomizovanou studií, případně několika nezávislými studiemi
- III – tvrzení je podepřeno názorem uznávaných odborníků a klinickými zkušenostmi popsanými v kazuistických sděleních.
1) První epizoda CDI, nezávažné onemocnění: Základním lékem je metronidazol, podávaný v dávce 3x 500 mg, p.o. nebo i.v. (A-I,II). Alternativně je možné podat vankomycin v dávce 4x 125 mg (B-I) nebo fidaxomicin v dávce 2x 200 mg (B-I). Oba jmenované přípravky jsou účinné, považují se však za rezervní, proto by v této indikaci neměly být podávány jako léky první volby. Doba léčby u všech tří antibiotik činí 10 dní.
Příznivý efekt podání specifických monoklonálních protilátek proti toxinům A a B dosud není podepřen spolehlivými studiemi (C-I).
V případě nezávažné CDI, jasně indukované předchozí antibiotickou terapií, a při nízkém riziku přenosu na další vnímavé osoby, je akceptovatelné vysadit antibiotikum, které vedlo ke vzniku CDI, a během dalších 48 hodin pozorně sledovat klinický efekt tohoto opatření. Pokud dojde ke zhoršení stavu, je nutné okamžitě zahájit medikamentózní léčbu. (C-II).
Cave: Použití probiotik nebo polymerů a pryskyřic vázajících toxiny je v této indikaci nevhodné (D-I).
2) Těžká forma CDI: Klinické a laboratorní parametry definující těžkou CDI jsou uvedeny v části doporučení věnující se klinickému obrazu onemocnění.
a) Jestliže pacient přijímá orální léky, je lékem volby vankomycin v dávce 4x 125 mg (A-I) nebo fidaxomicin v dávce 2x 200 mg (B-I). V dosud provedených studiích nevycházel fidaxomicin jako méně účinný než vankomycin, data však zatím nejsou dostatečně robustní. Dávkování vankomycinu je možné při prokázané nebo předpokládané poruše peristaltiky zvýšit až na 4x 500 mg (B-III); zdůvodnění je uvedeno výše u hesla Vankomycin.
Doporučená doba léčby u obou antibiotik činí 10 dní.
Cave: Perorální léčba metronidazolem se u těžkých forem CDI nedoporučuje, protože kontrolované studie prokázaly, že metronidazol má u této skupiny pacientů signifikantně horší léčebný efekt než vankomycin (D-I).
b) V situaci, kdy pacient perorální léčbu netoleruje, ale má zachovanou peristaltiku, se podává i.v. metronidazol v dávce 3x 500 mg (A-II). Tuto léčbu lze kombinovat s vankomycinem 4x 500 mg enterálně, t. j. žaludeční nebo jejunální sondou (B-III). Doba léčby činí 10 dní.
c) Dosud není jasné, jak medikamentózně nejlépe léčit pacienta s ileem. Obvykle se v této situaci podává i.v. metronidazol v dávce 3x 500 mg, v kombinaci s vankomycinem ve formě retenčních klyzmat (500 mg po 4-12 hodinách). V literatuře není shoda týkající se optimálního dávkování a délky léčby intrakolonicky podávaným vankomycinem.
Další možností je podání tigecyklinu 2x 50 mg i.v., doporučení je však zatím podloženo jen jednotlivými kazuistikami (C-III). Doba podávání tigecyklinu v publikovaných případech byla obvykle 14 dní, není však zřejmé, jestli tato doba je skutečně optimální.
Teoreticky by při nemožnosti orální léčby mohla být nejvýhodnější kombinace tigecyklinu podaného intravenózně s vankomycinem podaným enterálně, zatím však nejsou k dispozici žádné relevantní údaje z klinické praxe.
Indikace pro chirurgickou léčbu jsou uvedeny výše u hesla Kolektomie s terminální ileostomií.
3) První rekurence nebo riziko rekurence CDI: Faktory přispívající ke vzniku rekurence jsou v podstatě totožné s disponujícími faktory uvedenými v tabulce 1.
Postupem volby je podání fidaxomicinu v dávce 2x 200 mg (B-I) nebo vankomycinu v dávce 4x 125 mg (B-I). Méně spolehlivou alternativou je podání metronidazolu v dávce 3x 500 mg, p.o. nebo i.v. (C-I). Doba léčby ve všech případech činí 10 dní.
Incidence druhé rekurence je po léčbě první rekurence CDI orálním metronidazolem nebo vankomycinem srovnatelná. Naproti tomu pravděpodobnost druhé rekurence je po léčbě fidaxomicinem ve srovnání s vankomycinem nižší. V prospektivních randomizovaných studiích nebylo prokázáno, že by léčba fidaxomicinem vedla ke snížení frekvence rekurencí infekce ribotypem 027, a to na rozdíl od infekce ribotypy non-027, kde to prokázáno bylo.
4) Mnohočetné rekurence CDI: Podle dosavadních znalostí se jako nejúčinnější léčba jeví fekální bakterioterapie kombinovaná s předchozí antibiotickou léčbou (A-I). Postup je popsán v kapitole Terapeutické možnosti.
Medikamentózně lze podat fidaxomicin v dávce 2x 200 mg po dobu 10 dní (B-I) nebo vankomycin v sestupném dávkování, t.j. 4x 125 mg po dobu 10 dní a poté jeden týden 125 mg 2x denně, další týden 125 mg 1x denně, třetí týden 125 mg obden a čtvrtý týden 125 mg každý třetí den (B-I). Do úvahy je nutné vzít, že zatím nejsou k dispozici prospektivní randomizované studie hodnotící efekt fidaxomicinu u pacientů s mnohočetnými rekurencemi CDI.
Méně spolehlivou možností je podání vankomycinu v obvyklém režimu, t.j. 4x 125 mg po dobu 10 dní (C-II).
Cave: Podání probiotik ani pasivní imunizace pomocí hyperimunního séra proti klostridiovým toxinům se neukázaly jako dostatečně účinné (D-I). Podání metronidazolu v této indikaci rovněž není vhodné (D-II).
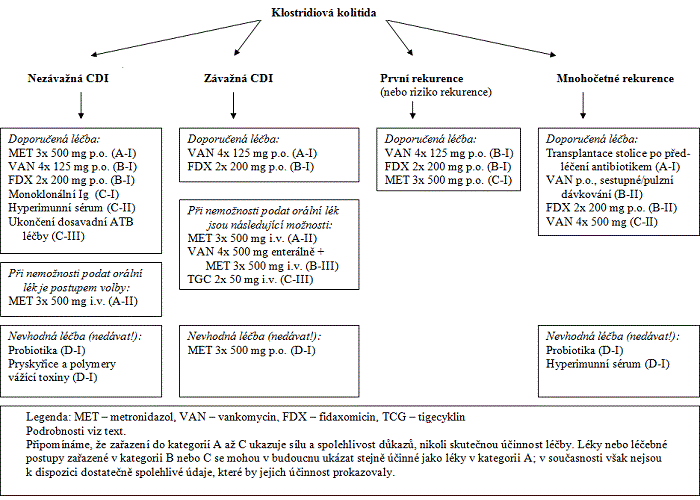
Obr. 1.: Schéma terapeutických možností CDI
Hodnocení efektu léčby
Je důležité si uvědomit, že léčebný efekt se u různých antibiotik objevuje různě rychle. Při léčbě metronidazolem se může odpověď na léčbu objevit až po 3-5 dnech. Efekt vankomycinu je rychlejší a měl by být patrný během 2-3 dnů. Podle předběžných zpráv působí fidaxomicin ještě rychleji, takže jeho účinek by se měl projevit do 48 hodin.
Pro praxi z toho vyplývá, že neobjeví-li se klinické a laboratorní známky ústupu nemoci do jmenované doby, je třeba hledat příčinu tohoto stavu. V úvahu připadá zejména
- přítomnost jiné střevní infekce (superinfekce střeva kvasinkami, viry nebo podmíněně patogenními gram-negativními tyčinkami)
- přítomnost jiného střevního onemocnění s podobnými klinickými projevy (např. dosud nepoznaná ulcerózní kolitida)
- přítomnost patologických změn trávicího traktu, které znesnadňují vyléčení standardními prostředky (např. divertikly tračníku, do nichž orálně podaný vankomycin nepronikne v dostatečné koncentraci)
- nedostatečná účinnost léčby v důsledku špatné compliance pacienta
Upozornění: Efekt léčby CDI nelze hodnotit podle výsledků bakteriologického vyšetření stolice. Pacient po překonané klostridové kolitidě může mít pozitivní nález GDH nebo toxinů A a B ve stolici a takový nález bez klinických projevů nemoci není důvodem k léčbě ani k zavedení izolačního režimu.
Klostridiová kolitida v dětském věku
Na rozdíl od dřívějších představ se nyní připouští, že CDI může postihnout i malé děti včetně novorozenců. Léčebná doporučení pro postižené děti jsou v zásadě shodná jako u dospělých. Z antibiotik je doporučován metronidazol nebo p.o. vankomycin; údaje o možnosti podat fidaxomicin jsou zatím jen útržkovité. Ojediněle byl popsán příznivý efekt fekální transplatnace při rekurentním průběhu CDI u dítěte v předškolním věku.
Klostridiová kolitida ve zdravotnickém zařízení
C. difficile je u nás i celosvětově nejčastějším a nejvýznamnějším vyvolavatelem průjmových onemocnění ve zdravotnických zařízeních.
Zvláštnosti klostridiové infekce lze shrnout do následujících bodů:
- Hospitalizovaní pacienti mají z různých příčin mnohonásobně vyšší vnímavost k infekci než zdravé osoby (viz Tab. 1).
- Infekce vyvolané C. difficile mohou být exogenní i endogenní. Zdrojem exogenní infekce jsou nejčastěji spóry klostridií, které přežívají v pacientských pokojích. Při nedodržování běžných hygienických pravidel může dojít i k přímému přenosu infekce z jednoho pacienta na druhého.
- Velké množství infekčních spór se tvoří ve střevním traktu pacientů s klinickými projevy CDI. U asymptomatických nosičů je množství vyloučených spór malé.
Opatření k zábraně šíření infekce
Základní opatření snižující výskyt CDI ve zdravotnickém zařízení se zaměřují na prevenci kolonizace pacientů (zábrana přenosu spor na vnímavé jedince) a na snížení rizika rozvoje onemocnění u již kolonizovaného pacienta (především jde o omezování antibiotické léčby a výběr přípravků, které méně ovlivňují střevní ekosystém). Preventivní opatření mají být cílená jak na zdroj infekce (izolace pacienta), tak na zamezení přímého přenosu na další osoby (bariérová opatření, mytí rukou), ale i na snížení kontaminace prostředí (speciální úklidová opatření s použitím sporicidních prostředků).
Zdroj infekce a cesta přenosu
Ve střevním traktu osob s klinickými projevy CDI se tvoří velké množství spór. Hlavním zdrojem infekce v nemocničním prostředí je tedy symptomatický pacient.
Kontaminované pevné povrchy a prostředí jsou dalším významným článkem v šíření infekce. Vegetativní formy klostridií mohou v prostředí přežívat jenom krátkodobě (do 24 hod.), ale spóry zde můžou přetrvávat po řadu měsíců a jsou vysoce rezistentní k běžně užívaným dezinfekčních prostředků. Přenos infekce na vnímavého pacienta se uskutečňuje především prostřednictvím kontaminovaných rukou personálu a dále kontaminovanými vyšetřovacími a ošetřovacími přístroji a pomůckami (fonendoskopy, teploměry, tlakoměry, endoskopy atd.).
Při zvýšeném výskytu klostridiových infekcí bývá pozorován i zvýšený výskyt asymptomatických nosičů (pacienti, personál), kteří ojediněle mohou přispívat k šíření nákazy. Bylo prokázáno, že léčba asymptomatických nosičů metronidazolem nesnižuje kolonizaci jejich zažívacího traktu. Použití vankomycinu může kolonizaci eliminovat, v prostředí obsahujícím spóry klostridií však po vysazení antibiotika rychle dochází k rekolonizaci stejným nebo jiným kmenem. Z tohoto důvodu se léčba nosičů nedoporučuje.
Hygiena rukou a ochranné oblečení
V současnosti se v prevenci přenosu většiny infekcí doporučuje dezinfekce rukou alkoholovými přípravky. Tyto přípravky skutečně působí na většinu nozokomiálních patogenů, vůči spórám C. difficile jsou však neúčinné. V prevenci přenosu této infekce se proto doporučuje mytí rukou mýdlem a vodou. Jde o mechanickou očistu, jejímž cílem je maximální snížení denzity kontaminujících spór na rukou. Po důkladném osušení je následně vhodné použít alkoholový dezinfekční prostředek jako prevenci přenosu ostatních nozokomiálních patogenů.
Dalším opatřením zamezujícím kontaminaci rukou při péči o pacienta s CDI je použití jednorázových rukavic. Toto opatření je namístě při každém fyzickém kontaktu s pacientem s akutním průjmem vyvolaným C. difficile nebo s jeho okolím. Nošení rukavic je zcela nezbytné v situacích, kdy může dojít ke kontaminaci rukou stolicí. Zároveň však bylo prokázáno, že použití rukavic nenahrazuje mytí rukou, proto po jejich sejmutí je nutné umytí rukou mýdlem a vodou. Dále je vhodné používat jednorázové pláště, a to při všech činnostech, při kterých může dojít ke kontaminaci pracovního oblečení spórami (mytí pacienta, jeho polohování, výměna plen).
Jednorázové ochranné pomůcky si ošetřující personál má obléknout před vstupem do izolačního prostoru a svléknout před opuštěním pokoje pacienta. Použité pomůcky se ještě na pokoji odkládají do speciálních nádob či pytlů, a v nich se posléze odvážejí k likvidaci.
Izolační opatření
Pacienti se suspektní nebo prokázanou klostridiovou infekcí mají být umístěni v samostatném pokoji a má být pro ně vyčleněno zvláštní sociální zařízení. Jestliže u pacienta s podezřením na CDI neprokáže tato infekce pomocí rutinního mikrobiologického vyšetření (viz výše), izolační opatření se zruší. V případě výskytu více případů je možná současná izolace více pacientů na jednom pokoji – vytvoření kohorty. Při zvýšeném výskytu CDI na jednom pracovišti je kohortace pacientů výhodnější, protože se tak omezí rozsah kontaminace.
Pacientovi, který je hospitalizován v izolačním režimu, se vyhradí všechny nutné ošetřovací a vyšetřovací pomůcky (fonendoskop, teploměr, tlakoměr mycí pomůcky atd.); tyto pomůcky zůstanou spolu s ním na pokoji. Dokumentace naopak zůstává trvale mimo izolační pokoj. Pohyb pacienta mimo izolační pokoj musí být minimalizován. Při nutnosti provedení speciálních vyšetření a zákroků, které nelze provést na pokoji, je nutné dodržovat opatření snižující riziko dalšího šíření infekce. Musí-li být pacient z diagnostických nebo léčebných důvodů transportován na jiné oddělení, musí být personál tohoto oddělení předem informován o tom, že u pacienta je nutné dodržovat izolační režim. Musejí být přijata opatření, která zabrání kontaktu s dalšími pacienty. Po provedení výkonu je nutné provést adekvátní dezinfekci všude, kde se pacient zdržoval.
Jestliže zdravotnické zařízení nedisponuje izolačními pokoji a přesto musí pacienta s klostridiovou kolitidou ošetřovat, doporučují zahraniční autoři jako nouzové řešení zavést prostorovou separaci pacienta. Tímto opatřením se myslí vytvořit 3-krokový odstup mezi lůžky s viditelným označením zóny izolace (např. barevnou páskou na podlaze), se současným využitím ostatních doporučených postupů omezujících riziko přenosu infekce (hygiena rukou, jednorázové ochranné pomůcky, dezinfekce prostředí).
Dezinfekce ploch a povrchů
Používání běžných čistících a dezinfekčních prostředků k úklidu pokojů zamořených spórami klostridií je nedostatečné. Pro úklid kontaminovaných ploch je nutné zavést dezinfekční prostředky s deklarovanou sporicidií, s dodržováním doporučených koncentrací a času působení výrobcem. Výběr vhodných čistících a dezinfekčních prostředků je v kompetenci nemocničních epidemiologů a hygieniků.
Dezinfekce ploch a povrchů v pokojích, kde se zdržují pacienti s CDI, se má provádět minimálně 1x denně. Dotyková místa jako jsou lůžka a jejich okolí, postranice, noční stolky, hrazdy, vypínače, sanitární keramika, stojany, pumy je lépe dezinfikovat i vícekrát denně, v závislosti na riziku kontaminace. Toalety a mobilní záchody by měly být dezinfikovány po každém použití.
Jestliže byl pacient s CDI vyšetřován koloskopicky nebo rektoskopicky, je nutné použité přístroje ošetřit tak, aby se nemohly stát zdrojem infekce pro jiné pacienty.
Po propuštění pacienta se má provést závěrečný důkladný celoplošný úklid pokoje s použitím sporicidních prostředků.
Edukace personálu a návštěvníků
Jedno z nejúčinnějších opatření v zamezení šíření CDI je seznámení celého spektra zaměstnanců podílejících se na péči o pacienty (lékaři, střední zdravotnický personál, pomocný zdravotnický personál, personál úklidu) se specifickými rysy této infekce. Nejen lékaři, ale i ostatní ošetřující pracovníci by měli znát základní patofyziologii onemocnění, problematiku kontaminace prostředí a možných cest přenosu, a také opatření zamezující dalšímu přenosu (hygiena rukou, používání ochranných pomůcek, izolačních opatřeních). Je nutné zdůraznit, že prevence šíření infekce je týmovou záležitostí a bez zapojení pomocného zdravotnického personálu a personálu zajišťujícího úklid nelze dosáhnout úspěchu.
Každý návštěvník má být poučen o povaze infekce a nutnosti dodržování bariérových opatření, především o postupu mytí rukou před opuštěním pokoje pacienta. Pokud se podílí na péči o pacienta, má používat jednorázové rukavice a ochranný plášť.
Hlášení výskytu CDI
Klostridiová kolitida není zahrnuta ve výčtu povinně vykazovaných infekcí, které jmenuje Vyhláška č. 473/2008 Sb. o systému epidemiologické bdělosti pro vybrané infekce. Nicméně v souladu se zněním § 62 Zákona 258/2000 Sb. o ochraně veřejného zdraví jsou poskytovatelé léčebné péče povinni její výskyt hlásit příslušným epidemiologickým oddělením Krajské hygienické stanice (KHS). Podle posledního vydání Mezinárodní klasifikace nemocí (platného od 1.1.2012) přísluší klostridiové kolitidě kódové označení A04.7.
Použitá literatura
- Bauer MP, Notermans DW, van Benthem BH, et al; ECDIS Study Group. Clostridium difficile infection in Europe: a hospital-based survey. Lancet 2011; 377(9759): 63-73.
- Bauer MP, Kuijper EJ, van Dissel JT. European Society if Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Inf 2009; 15: 1067-1079.
- Beneš J. Kolitida vyvolaná Clostridium difficile. In: Beneš J. Infekční lékařství. 1 vydání. Praha, Galén 2009: 271-273.
- Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin Mikrobiol Inf Lék 2006; 12(6): 247-251.
- Bergmann D, Koten J, Beneš Z, Kohout P, Chlumská A. Pseudomembranózní kolitida. Vnitř Lék 2007; 53(10): 645-652.
- Carrico RM, Bryant K, Lessa F, et al. Guide to Preventing Clostridium difficile Infection. 2013 www.apic.org/implementationguides
- Cohen AH, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31 (5): 431-455.
- Džupová O, Beneš J. Clostridium difficile a klostridiová kolitida - co je nového? Klin Mikrobiol Inf Lék 2008; 14(3): 115-117.
- Gerding DN, Muto CA, Owens RC. Measures to Control and Prevent Clostridium difficile Infection. CID 2008; 46(1): 43-49.
- Henrich TJ, Krakower D, Bitton A, Yokoe DS. Clinical risk factors for severe Clostridium difficile – associated disease. Emerg Infect Dis 2009; 15(3): 415-22.
- Krůtová M, Matějková J, Nyč O. První výsledky molekulární typizace Clostridium difficile v ČR. Zprávy centra epidemiologie a mikrobiologie. 2013; 22(12): 399-401.
- Lancester JW, Matthews SJ. Fidaxomicin: the newest addition to the armamentarium against Clostridium difficile infection. Clin Ther 2012; 34: 1-13.
- Louie TJ, Miller MA, Mullane KM, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med 2011; 364: 422-431.
- Matejková J, Nyc O, Melter O. Zkušenosti s využitím nových testů pro detekci Clostridium difficile. Klin Mikrobiol Infekc Lek 2010; 16(3): 90-2.
- McFarland LV, Elmer GW, Surawicz CM.Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol 2002; 97(7): 1769-75.
- Nelson RL, Kelsey P, Leeman H, et al. Antibiotic treatment for Clostridium difficile-associated diarrhea in adults. Cochrane Database Syst Rev 2011; 7(9).
- van Nispen tot Pannerden CM, Verbon A, Kuipers EJ. Recurrent Clostridium difficile infection: what are the treatment options? Drugs 2011; 71(7): 853-868.
- Nyč O, Pituch H, Matějková J, et al. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet 2011; 377(9775):1407.
- Nyč O, a Pracovní skupina pro Clostridium difficile. Současné přístupy v laboratorní diagnostice střevních infekcí vyvolaných Clostridium difficile. Zprávy CEM 2011; 9: 334-337.
- Nyč O. Přístup k léčbě střevních infekcí způsobených bakterií Clostridium difficile. Klin Mikrobiol Infekc Lek 2010; 16(3): 93-6.
- Pant C, Deshpande A, Altaf MA, et al. Clostridium difficile infection in children: a comprehensive review. Curr Med Res Opin 2013; 29(8):967-84.
- Polák P, Freibergerová M, Juránková J, et. al. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Inf Lék 2011; 17: 214-217.
- Polívková S, Sýkorová B, Džupová O, et al. Výskyt a charakter infekcí vyvolaných Clostridium difficile u pacientů s průjmovým onemocněním v pražské fakultní nemocnici. Klin Mikrobiol Inf Lék 2010; 16(6): 206-210.
- Russell G, Kaplan J, Ferraro M, Michelow IC. Fecal bacteriotherapy for relapsing Clostridium difficile infection in a child: a proposed treatment protocol. Pediatrics 2010;126(1):e239-42.
- Schutze GE, Willoughby RE. Clostridium difficile infection in infants and children. Pediatrics 2013; 131(1):196-200.
- Shah D, Dang MD, Hasbun R, et al. Clostridium difficile infection: update on emerging antibiotic treatment options and antibiotic resistance. Expert Rev Anti Infect Ther 2010; 8(5): 555–564.
- Surawicz CM, Brandt LJ,Binion DG, et al. Guidelines for Diagnosis, Treatment, and Prevention of Clostridium difficile Infection. Am J Gastroenterol. 2013; 108: 478-498.
- Vojtilová L, Freibergerová M, Juránková J, et al. Analýza souboru pacientů s onemocněním vyvolaným toxinem Clostridium difficile hospitalizovaných na Klinice infekčních chorob v Brně v letech 2007-2010.Klin Mikrobiol Inf Lék 2011; 17: 208-213.
- Vonberg RP, Kuijper EJ, Wilcox MH, et al. Infection kontrol measures to limit the sprej of Clostridium difficile. Clin Microbiol Infect. 2008; 14(5): 2-20.
- Votava M, Šlitrová B. Srovnání citlivosti spor Bacillus subtilis a spor českých kmenů Clostridium difficile vůči dezinfekčním prostředkům. Epidemiol Mikrobiol Imunol. 2009; 58: 36-42.
- Wenisch JM, Schmid D, Tucek G, et al. A prospective cohort study on hospital mortality due to Clostridium difficile infection. Infection 2012; 40(5): 479-84.
- Wilcox MH. Updated guidance on the management and treatment of Clostridium difficile infection. Public Health England, 2013.
|

