Pokroky a úskalí v léčbě chronické HCV infekce
P. Chalupa, H. Rozsypal, 7. 9. 2018
Úvod
Obdobně jako jiné vyspělé státy, čelí i ČR následkům neléčené, resp. nevyléčené chronické infekce virem hepatitidy C (HCV). Riziko vzniku jaterní cirhózy do 20 let od infekce je 15-30 % a u řady těchto pacientů může vzniknout hepatocelulární karcinom (HCC). V poslední době se otevřely nové možnosti řešení. Po 20 letech léčby chronické infekce HCV založené na interferonu s ribavirinem se objevily vysoce účinné kombinace přímo působících antivirotik (DAA). Infekce HCV se dnes dá vyléčit, omezit poškození jater a významně zlepšit prognózu. O infekci HCV bylo napsáno již mnoho a stále vychází nové publikace, byly vydány národní a mezinárodní doporučené postupy. Věříme, že nabízený článek nebude jen opakovat informace nedávno vydaných přehledů, ale přispěje k lepší orientaci v složité problematice a přinese vysvětlení poznatků a souvislostí, kterým se v infektologickém písemnictví věnuje málo prostoru.
1. Výskyt infekce HCV ve světě a u nás
Evropská asociace pro studium jater (European Association for the Study of the Liver, EASL) z dubna 2018 uvádí, že celosvětově trpí infekcí HCV 71 milionů lidí. Odhady WHO mluví dokonce o 80 milionech v roce 2016. Většina lidí byla infikována ve 2. polovině 20. století po podání transfuze v důsledku operačního zákroku nebo injekčního užívání drog. V současné době jsou největší skupinou nakažených i.v. narkomani. Dle odhadu WHO žije v roce 2018 na celém světě ve 148 zemích světa asi 16 milionů i.v. narkomanů a z tohoto počtu má 10 milionů infekci HCV. Hned na druhém místě to jsou lidé, kteří byli nakaženi z krve nebo krevního derivátu před rokem 1992, kdy testování na HCV infekci ještě nebylo rutinní a povinné.
Existují odhady, že v ČR trpí HCV infekcí asi 80 000 obyvatel. [1]. Při chronické infekci HCV je většina pacientů asymptomatických, tedy bez klinických obtíží, ale onemocnění u nich progreduje, v játrech přibývá vaziva a po letech může dojít k nějaké závažné komplikaci (ikteru, dekompenzaci cirhózy jater, krvácení z jícnových varixů nebo HCC).
2. Nové možnosti léčby infekce HCV
Léčba tohoto onemocnění od roku 2011 vstoupila do zcela nové éry. Dnes umíme chronickou infekci HCV účinně a dokonce v krátkém čase (8 až 12 týdnů) zcela vyléčit. Bylo to díky rychlému zavádění přímo působících antivirotik – DAA (Directly Acting Antivirals), která se nyní podávají perorálně v bezinterferonových (IFN-free) léčebných režimech. DAA jsou vysoce účinná, bezpečná, mají minimum kontraindikací a nežádoucích účinků, pouze jedinou nevýhodou je zatím jejich velmi vysoká cena. Přehled přímo působících antivirotik - monokomponentních a kombinovaných přípravků uvádí tabulka 1.
Tabulka 1: Přehled přímo působících antivirotik - monokomponentních a kombinovaných přípravků
| Třída | název | účinná látka | monokom- ponentní přípravek | kombinovaný přípravek | |||||
| Harvoni | Viekirax | Zepatier | Epclusa | Vosevi | Maviret | ||||
| inhibitory NS3/4A proteázy | -previr | simeprevir | Olysio | ||||||
| asunaprevir | Sunvepra | ||||||||
| paritaprevir | + | ||||||||
| grazoprevir | + | ||||||||
| voxilaprevir | + | ||||||||
| glekaprevir | + | ||||||||
| inhibitory replikačního komplexu NS5A | -asvir | daklatasvir | Daklinza | ||||||
| ledipasvir | + | ||||||||
| ombitasvir | + | ||||||||
| elbasvir | + | ||||||||
| velpatasvir | + | + | |||||||
| pibrentasvir | + | ||||||||
| inhibitory NS5B (RNA) polymerázy | -buvir | sofosbuvir | Sovaldi | + | + | + | |||
| dasabuvir | Exviera | ||||||||
3. Organizace léčebné péče o pacienty s infekcí v ČR
Od 1. ledna 2016 došlo v ČR k významné změně v systému léčby této infekce. Všechny preparáty IFN-free režimů jsou zařazeny do systému „centrové léčby“ a na webových stránkách České hepatologické společnosti ČLS JEP i na našich stránkách lze vyhledat pracoviště, která aktuálně tuto léčbu v ČR poskytují.
Pro chronickou HCV infekci je v ČR vypracován doporučený diagnostický a terapeutický postup, jeho poslední verze je z roku 2017 [2] a uvádí pro léčbu chronické infekce HCV způsobenou jednotlivými genotypy 1 až 6 varianty IFN-free režimů, které v současné době v ČR používáme (viz níže). V roce 2018 vydala Evropská asociace pro studium jater (EASL) k této problematice nové, aktualizované doporučení [3, 4] a lze předpokládat, že do budoucí verze českého doporučeného postupu budou tyto aktualizace nepochybně zapracovány. V léčebných schématech EASL se již objevily preparáty, se kterými zatím v ČR nemáme větší zkušenosti. Jedná se o MaviretTM (glekaprevir + pibrentasvir) a VoseviTM (sofosbuvir + velpatasvir + voxilaprevir).
4. Posouzení stupně fibrózy
Prognóza, léčba a management pacientů s chronickým jaterním onemocněním závisí na stupni jaterní fibrózy. Dlouhou dobu byla „zlatým standardem“ této diagnostiky jaterní biopsie. V poslední dekádě ale došlo k prudkému rozvoji neinvazivních možností detekce stupně jaterní fibrózy. Existují dva odlišné, ale komplementární způsoby detekce stupně jaterní fibrózy. Buď je to vyšetření sérových biomarkerů, nebo vyšetření elasticity jater.
4.1. Biopsie jater
Histologické vyšetření biopsie jater bylo mnoho let základem stanovení stadia (staging) fibrózy jater. Histologie poskytovala informaci nejen o stupni fibrózy (množství vaziva), ale i o zánětlivé (nekroinflamatorní) aktivitě procesu (stupeň, grading). V průběhu let byly vyvinuty skórovací systémy, jako např. Ishakovo skóre nebo systém METAVIR (tab. 2). [5]
Tabulka 2: Stadia fibrózy jater v systému METAVIR (upraveno podle [5, 6]
| Stadium | Histologický nález |
| 0 | bez známek fibrózy |
| 1 | portální fibróza (vazivo omezené na portální pole) |
| 2 | periportální fibróza, ojedinělá septa |
| 3 | přemosťující fibróza (portoportální a portocentrální vazivová septa) |
| 4 | cirhóza (kromě sept přítomny i další histologické známky cirhózy) |
4.2. Sérové biomarkery
K určení fibrózy může posloužit vyšetření sérových biomarkerů, např. kyseliny hyaluronové, lamininu, YKL-40 (chondrexu), α2-makroglobulinu, N-terminální propeptid proktokolagenu III (RIIINP), type IV collagenu, tenascinu, undulinu, fibronektinu, cytokinů (TGF-beta, TGF-alfa a PDGF).
4.3. Transientní elastografie
Transientní elastografie (FibroScan) je nejpropracovanější a široce používaná metoda, se měří rychlost propagace příčných vln (o frekvenci 50 Hz) tkání po mechanickém impulzu. Čím tužší jaterní tkáň je, tím rychleji se vlny propagují. [7]
Definice
Metoda k zjišťování mechanických vlastností jaterní tkáně, které odráží podíl vaziva a tím stupeň fibrózy jater, popř. i obsah tuku a tím míry steatózy. (Je nejužívanějším druhem z dynamických elastografických metod.)
Účel
Slouží k posouzení stadia fibrózy a přítomnosti cirhózy jater, u chronické infekce VHC odráží pokročilost procesu. Vedlejším údajem je i detekce a kvantifikace steatózy. Vzhledem k naprosté bezpečnosti elastografie je možné ji provádět bez obav opakovaně a hodnotit změny jaterní tkáně v čase.
Princip
Deformace tkáně vyvolaná energetickým impulsem vyvolává příčné vlny (nesprávně označené jako střižné vlny). Energetické impulsy jsou u tranzientní elastografie vyvolány mechanickým vibrátorem (u jiných metod i akustickým tlakem silného fokusovaného ultrazvukového impulzu z tzv. zdroje ARFI - Acoustic Radiation Force Impulse) a způsobují posun tkání o 1-20 µm. Příčné vlny se šíří rychlostí 1-10 m/s, která je úměrná tuhosti prostředí podle Youngova modulu pružnosti:
E = 3.ρ.vs2,
kde ρ = 1047 kg/m3. Jednotky veličin: [E] = kPa, [vs] = m/s. Podle uvedeného vzorce s narůstající tuhostí jaterní tkáně stoupá rychlost šíření vln, hustotu lze zahrnout do konstanty úměrnosti. Přibližně vychází pro vs = 1,1 m/s ~ E = 3 kPa (u zdravých jater - F0), vs = 1,7 m/s ~ E = 9 kPa (u středně těžké fibrózy - stadia F2) a vs = 3,6 m/s ~ E = 40 kPa (u cirhózy jater - F4). Vzhledem k vysoké rychlosti příčných vln musí být příčné vlny registrovány vysokou čtecí frekvencí (podstatně vyšší než využívají ultrazvukové přístroje pro břišní sonografii). Příčné vlny se mohou šířit jen v pevném prostředí (v kapalinách a plynech se ztrácí*). Kromě rychlosti příčných vln se vyhodnocuje i útlum ultrazvukových vln vyjádřený úbytkem amplitudy UZ vln v decibelech na metr (dB/m). Ten je významnější při vyšším obsahu tuku v játrech.
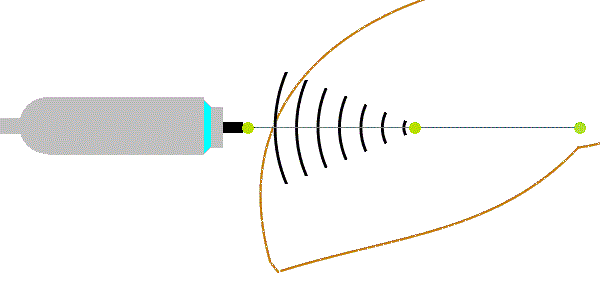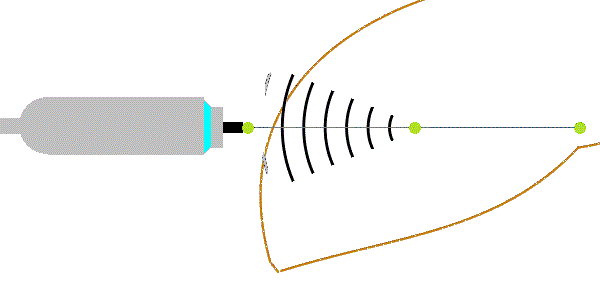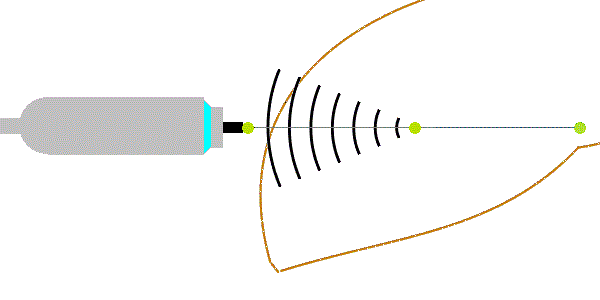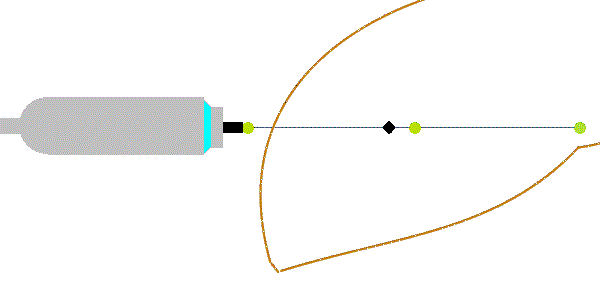
Obrázek 1: Fokusovaným mechanickým impulsem vyvolané příčné vlny
* Mimochodem na tomto faktu se zakládá i poznatek o tekutosti nebo alespoň plasticitě zemského jádra, v němž se ztrácí příčné zemětřesné vlny.
Provedení
Vyšetření se provádí přístrojem FibroScan (firmy Echosens). Sonda (s vibrátorem) se přikládá přibližně do 8.-9. mezižebří v poloze pacienta ležícího na zádech s úklonem trupu doleva a zvednutou pravou paží tak, aby se vyšetřil okrsek (váleček 1× 4 cm) tkáně pravého laloku jater v hloubce (podle sondy) 25-65 mm nebo 35-75 mm. Pacient musí být nalačno, jinak nevyžaduje speciální přípravu. V průběhu vyšetření je nutná dechová spolupráce jako při běžném ultrazvukovém vyšetření břicha. Nekomplikované vyšetření trvá 5-10 minut. Vyšetřit nelze asi 5-8 % pacientů, nejčastěji z důvodu významné obezity nebo absolutní neschopnosti zadržet dech. Vyšetřovat lze i děti.
Výsledek
Vzhledem k přímé úměrnosti rychlosti šíření příčných vln s elastickým odporem vyjádřeným ekvivalentem tuhosti v jednotkách tlaku se uvádí výsledek, a to jako medián z 10 úspěšných měření. Za spolehlivé vyšetření se považuje takové, kde podíl úspěšných měření je vyšší než 60 % a interkvartilový rozptyl všech měření je nižší než 10 %. Čím vyšší rychlost, tím vyšší stadium fibrózy až cirhóza jater (v tab. 3). Vedlejším údajem měření je tzv. parametr CAP (controlled attenuation parameter), který vyjadřuje míru snížení amplitudy (oslabení) ultrazvukových vln při průchodu jaterní tkání vyjádřený v decibelech na metr (dB/m). Čím větší hodnota oslabení UZ vln, tím vyšší je míra steatózy (mírná steatóza orientačně okolo 200 dB/m, těžká steatóza >300 dB/m).
Tabulka 3: Stadia fibrózy jater podle výsledků elastografie
| Stadia systému METAVIR | ||||
| F0-F1 | F2 | F3 | F4 | |
| Fibróza | chybí nebo mírná (absent or mild) |
významná (significant) |
závažná (severe) |
cirhóza jater |
| Elasticita* [kPa] | 2,5-7 | 7-9,5 | 9,5-12,5 | 12,5-75 |
* elasticita vyjádřená Youngovým modulem pružnosti jako poměr mezi aplikovaným tlakem a vyvolaným pnutím
Dodatek
Srovnatelná metoda s FibroScanem je elastografie využívající ARFI (Acoustic Radiation Force Impulse) – jedná se o vyslání silného a přitom krátkého akustického signálu (0,3 ms) s následnou detekcí šíření vln sondou. Vyšetření se provádí na ultrasonografickém přístroji Siemens Accuson S2000.
5. Přítomnost extrahepatálních manifestací infekce HCV
Tabulka 4: Extrahepatální projevy HCV infekce, jejich asociace s HCV a nejdůležitější patofyziologické mechanismy jejich rozvoje - upraveno podle [8]
| Extrahepatální projevy | Prevalence anti-HCV (%) | Patofyziologický mechanismus |
| Smíšená kryoglobulinemie | 80-95 | Proliferace B-lymfocytů a blokáda apoptózy vedoucí k produkci IgM s aktivitou RF |
| Membranoproliferativní glomerulonefritida | 10-60 | Glomerulární depozita cirkulujících imunokomplexů obsahující virové antigeny, HCV RNA, anti-HCV a kryoglobuliny |
| Non-hodgkinský lymfom | 0-33 | Smíšená kryoglobulinemie s monoklonální proliferací B-lymfocytů |
| Autoimunitní thyreopatie | 10 | Indukce autoprotilátek |
| Porphyria cutanea tarda | 60 | Není známo |
| Lichen planus | 0-65 | HCV specifická T-buněčná odpověď |
Tabulka 5: Nejčastější klinické projevy a onemocnění, která mohou s HCV infekcí souviset a představovat její extrahepatální manifestaci
| Klinický nález | Onemocnění |
| Kardiovaskulární nemoci | Iktus Ischemická choroba srdeční Ateroskleróza koronálních cév a karotid |
| Hypertenze | Membranoproliferativní glomerulonefritida Jiné nefropatie (např. IgA nefropatie, fokální a segmentální glomeruloskleróza) |
| Renální insuficience | Membranoproliferativní glomerulonefritida |
| Onemocnění štítné žlázy | Autoimunitní tyreopatie hypo- i hyperfunkční *) Papilární karcinom štítné žlázy |
| Metabolismus sacharidů | Diabetes mellitus 2. typu Inzulinová rezistence |
| Mozek a nervový systém | Únava Kognitivní poruchy Periferní symetrické neuropatie |
| Onemocnění oka | Moorenův korneální vřed Sicca syndrome (Sjögrenův syndrom) Episkleritida Retinopatie |
| Onemocnění kůže | Lichen planus Porphyria cutanea tarda Kryoglobulinemická vaskulitida Polyarteritis nodosa CREST syndrom (forma sklerodermie - C podkožní kalcifikace, R Raynaudův fenomén, E porucha motility ezofagu, S sklerodaktylie, T teleangiektazie) |
| Lymfadenopatie | Lymfoproliferativní onemocnění |
| Horečka | Kryoglobulinemie Kryoglobulinemická vaskulitida Lymfoproliferativní onemocnění |
| Artralgie, slabost | Kryoglobulinemie B-buněčný non-Hodgkinův lymfom Kryoglobulinemická vaskulitida |
| Produkce autoprotilátek | Např. kryoglobulinů, revmatoidního faktoru, antinukleárních protilátek, antikardiolipinových protilátek, protilátek proti antigenům štítné žlázy, proti hladnému svalu |
*) Z minulosti jsou známé tyreopatie jako nežádoucí účinek při léčbě interferonem alfa
6. Výběr pacientů k léčbě
6.1. Indikace
Kandidáti na protivirovou léčbu by měli být všichni pacienti s chronickou infekcí HCV, dosud protivirově neléčeni nebo v minulosti léčeni neúspěšně (tj. bez dosažení SVR = sustained viral response, setrvalé virologické odpovědi). Léčba by měla být bezodkladně poskytnuta pacientům s významnou fibrózou (METAVIR F2 nebo F3) a s jaterní cirhózou (METAVIR F4), včetně dekompenzované cirhózy jater. Indikace k přednostnímu zahájení léčby by měla být u pacientů s projevy mimojaterního postižení (např. symptomatická kryoglobulinemie, HCV-asociovaná imunokomplexová nefropatie, HCV asociované non-Hodgkinské lymfomy a jiné), dále u pacientů s rekurencí infekce HCV po transplantaci jater, u pacientů ve vysokém riziku rychlé progrese jaterní fibrózy při komorbiditách (zejména osoby po orgánových transplantacích, po transplantaci kostní dřeně, diabetici), osoby představující epidemiologické riziko – aktivní uživatelé drog, muži mající sex s muži (MSM), ženy plánující graviditu, pacienti v chronickém dialyzačním programu.
Aktivní uživatelé drog a MSM by měli být poučeni o možných rizicích reinfekce po úspěšné terapii a měli by souhlasit s účastí v preventivních programech různého typu. Osoby s dekompenzovanou cirhózou jater (Child-Pugh B nebo C) a MELD skóre ≥18-20 bodů by měly nejdříve podstoupit transplantaci jater a teprve poté protivirovou léčbu (pravděpodobnost reparace jaterních funkcí a dlouhodobé přežití bez transplantace je velmi nízká). Kontraindikací k léčbě jsou také případy pacientů, jejichž krátkodobé a střednědobé přežití je limitováno závažným přidruženým onemocněním. Kalkulátory k výpočtu Childovu-Pughové skóre, MELD skóre (Model For End-Stage Liver Disease) od 12 let věku, případně PELD skóre (Pediatric End-Stage Liver Disease) pro mladší 12 let, jsou k dispozici zde.
Tabulka 6: Klinická stadia jaterní encefalopatie
| Stupeň | ||||
| 1 | 2 | 3 | 4 | |
| Klinický obraz | mírná zmatenost, euforie či deprese, snížená pozornost, zpomalené myšlení, zvýšená dráždivost, porucha spánkového režimu | únava, letargie, výrazná porucha schopnosti řešit logické úlohy, zjevné změny osobnosti, neadekvátní chování, přechodná dezorientace | somnolence, neschopnost řešit logické úlohy, dezorientace místem i časem, značná zmatenost, amnesie, nesrozumitelná řeč | kóma |
Tabulka 7: Childa-Pughové skóre pro odhad letality cirhózy jater
| 1 | 2 | 3 | |
| encefalopatie | není | stupně 1-2 | stupně 3-4 |
| ascites | nepřítomný | mírný | velký |
| bilirubin (µmol/l) | <34,2 <70* |
34,2-51,3 70-170* |
>51,3 >170* |
| albumin (g/l) | >35 | 28-35 | <28 |
| INR (index) | <1,7 | 1,7-2,2 | >2,2 |
* hodnoty pro primární biliární cholangitidu (PBC) a primární sklerotizující cholangitidu (PSC)
| Počet bodů | Stupeň | Přežití 1 rok | Přežití 2 roky |
| 5-6 | A | 100 % | 85 % |
| 7-9 | B | 81 % | 57 % |
| 10-15 | C | 45 % | 35 % |
MELD skóre (tab. 8) stratifikuje tíži terminálního onemocnění jater u dospělých (a dětí starších než 12 let), zejména pro plánování transplantace. Původně bylo vyvinuto v roce 2001 na Mayo klinice k odhadu přežití pacientů podstupujících zavedení transjugulárního portosystémového shuntu (TIPS). Dosahuje hodnot přibližně do 40 bodů. Bodovým hodnotám jsou přiřazena rizika úmrtí na selhání jater v následujících třech měsících. Hodnoty pod 9 bodů vyjadřují nízké riziko úmrtí (pod 2 %). U hodnot nad 11 bodů je doporučeno korigovat výsledek pomocí MELD-Na skóre, které zohledňuje hladinu sérového natria (hyponatrémie zvyšuje MELD skóre). U pacientů léčených hemodialýzou (2× týdně) nebo CVVHD (v posledním týdnu) se dosadí jednotná hodnota kreatininu 354 µmol/l (ostatně jako každá hodnota kreatininu vyšší než 354 µmol/l). Pro dětské pacienty do 12 let se používá obdoba MELD skóre - PELD skóre (tab. 9).
Tabulka 8: Model for End-Stage Liver Disease (MELD) Score s korekcí podle natremie [9-12]
|
|
||||||||||||
| MELD skóre | 3měsíční letalita |
≥40
|
71 %
|
30–39
|
53 %
|
20–29
|
20 %
|
10–19
|
6 %
|
≤9
|
2 %
|
|
|
|||||||||
Tabulka 9: Pediatric End-Stage Liver Disease (PELD) Score [13, 14]
|
|
||||||||||||||||||
* u kojenců
** pokud je přítomna růstová retardace (pod průměrem o alespoň dvojnásobek SD)
6.2. Volba léčebného režimu
Pro chronickou HCV infekci je v ČR vypracován doporučený diagnostický a terapeutický postup, jeho poslední verze je z roku 2017 a uvádí pro léčbu chronické HCV infekce způsobenou jednotlivými genotypy 1 až 6 dostupné varianty režimů bez interferonu (IFN-free), které v současné době v ČR používáme (viz tabulka).
Tabulka 2 ukazuje bezinterferonové režimy vhodné pro jednotlivé genotypy HCV. Jednotlivé konkrétní možnosti léčby pro každý genotyp jsou rozebrány níže.
Tabulka 10: Dostupné varianty bezinterferonových režimů pro jednotlivé genotypy HCV
| kombinace | genotypy HCV | ||||
| GT 1 | GT 2 | GT 3 | GT 4 | GT 5 a 6 | |
| sofosbuvir/ledipasivir ± ribavirin | ano | ne | ne | ano | ano |
| sofosbuvir/velpatasvir ± ribavirin | ano | ano | ano | ano | ano |
| ombitasvir/paritaprevir/(r) + dasabuvir ± ribavirin * | ano | ne | ne | ne | ne |
| ombitasvir/paritaprevir/(r) ± ribavirin * | ne | ne | ne | ano | ne |
| grazoprevir/elbasvir ± ribavirin | ano | ne | ne | ano | ne |
| sofosbuvir + daklatasvir ± ribavirin | ano | ano | ano | ano | |
| sofosbuvir + simeprevir ± ribavirin | suboptimální | ne | ne | ano | ne |
* (r) = ritonavir
V roce 2018 vydala Evropská asociace pro studium jater (EASL) k této problematice nové doporučení a lze předpokládat, že do budoucí verze českého doporučeného postupu budou tyto aktualizace zapracovány. V léčebných schématech EASL se např. již objevily preparáty, se kterými v ČR zatím zkušenosti nemáme. [5] Jedná se o MaviretTM (glekaprevir + pibrentasvir) a VoseviTM (sofosbuvir + velpatasvir + voxilaprevir).
7. Účinnost léčby antivirotiky
Zavedení DAA preparátů (Direct Acting Antivirals, přímo účinkující protivirové preparáty) do terapie chronické HCV infekce představuje velice významný pokrok v léčbě tohoto onemocnění. Cílem terapie je vyléčení HCV infekce, tedy dosažení trvalé eliminace viru z organismu. Eliminace viru brání rozvoji jak jaterních, tak i mimojaterních komplikací HCV infekce, včetně pokročilé jaterní fibrózy, CIH, dekompenzované CIH a rozvoji HCC. Vzhledem k tomu, že po léčbě DAA preparáty dosahujeme téměř ve 100 % trvalého vymizení HCV RNA z organismu, což hodnotíme za 12 týdnů (SVR12, sustained viral response 12), případně za 24 týdnů (SVR24) od ukončení léčby, považujeme HCV infekci v současné době za onemocnění, které umíme vyléčit. SVR12 a SVR24 spolu korelují v 99 % případů a dle dlouhodobých studií představuje dosažení SVR v 99 % případů trvalé vyléčení HCV infekce. Znamená to, že u osob, které dosáhly SVR, nedochází k pozdním relapsům onemocnění, ovšem reinfekce možná je (nejčastěji např. u narkomanů). Pro případy, kdy by po IFN-free léčbě nedošlo k SVR, bylo by možné použít některý z preparátů, který je pangenotypální, tedy má terapeutický efekt na infekce všemi HCV genotypy. Je to buď VoseviTM, nebo EpclusaTM, případně MaviretTM.
8. Limity léčby antivirotiky
I když DAA preparáty jsou nepochybně velkým přínosem a v převážné většině případů je pacienti velmi dobře snášejí, třeba pamatovat i na některá úskalí:
8.1. Lékové interakce
Před nasazením léčby s DAA preparátem třeba nejdříve zjistit, jakou chronickou léčbu pacient užívá, abychom předešli případným klinicky významným lékovým interakcím s jinými léky a zabránili tak jak možným nežádoucím účinkům, tak při kombinaci s jinými léky i riziku poklesu až ztrátě antivirového účinku. Tyto lékové interakce s léky používanými v hepatologii, lze snadno vyhledat a zjistit na internetu na adrese www.hep-druginteractions.org v databázi univerzity v Liverpoolu „HEP Drug Interaction Checker“. Jedná se o databázi, která je soustavně aktualizovaná, což je také zárukou získání aktuálních informací. Klinicky významné lékové interakce jsou možné především při kombinaci DAA s inhibitory protonové pumpy, statiny, perorálními antikoagulancii, inhibitory nebo induktory CYP3A4 či P glykoproteinu. Enzymatický systém cytochromu P450 je velkou skupinou „podrodin“ cytochromu P450, která metabolizuje chemické látky, se kterými přicházejí živé organismy neustále do styku. Některé léky vyvolávají zvýšenou enzymatickou aktivitu, tzv. indukci, jiná léčiva naopak enzymatickou aktivitu tlumí a způsobují tzv. inhibici (tab. 12). Důsledkem enzymatické indukce není jenom zrychlení metabolismu, ale i snížení plazmatických hladin a terapeutického účinku. Jiné léky mohou naopak biotransformační procesy inhibovat. Jako nejdůležitější z celého systému cytochromu P450 se jeví podrodina CYP3A. Jelikož inhibitory NS3/4A jsou substráty cytochromu P450 3A4 (CYP3A4), tak při současném podávání DAA s inhibitory CYP3A4 je možnost vzniku nežádoucích účinků a naopak při podávání s induktory CYP3A4 je riziko snížení až ztráty jejich antivirového účinku a taková léčiva mohou zabránit vyléčení a zmařit velké finanční prostředky vložené do terapie. Léčiva, která jsou induktory, případně inhibitory CYP3A4, uvádí tabulka 12.
Tabulka 12: Léčiva, která jsou induktory, případně inhibitory CYP3A4 - upraveno dle [15]
| Inhibitory CYP3A4 | Induktory CYP3A4 | |
|
Antidepresiva SSRI:
Azoly
|
Inhibitory proteáz
|
Antiepileptika
|
Nebezpečné může být i souběžné podávání DAA a fytofarmak nebo potravinových doplňků, z nichž řada působí na systém CYP3A4 a P glykoproteinu. Při terapii inhibitory NS3/4A nepít grapefruitovou šťávu, nejíst grapefruity, nebo plody pomela, neboť látky v nich obsažené působí jako inhibitor CYP3A4 a P glykoproteinu, což může vést ke zvýšenému výskytu nežádoucích účinků. Induktory CYP3A4 a P glykoproteidu, např. třezalka tečkovaná, šalvěj červenokořenná, ženšen pravý a další) vedou k poklesu až ztrátě antivirového účinku. Nejvýznamnější je třezalka tečkovaná (Hypericum perforatum, angl. St. John´s wort, obr. 2), která je nejen induktorem CYP3A4, ale i induktorem CYP3A5, CYP2C19, CYP2C9, P glykoproteinu a ovlivňuje tak efekt (dochází ke snížení až ztrátě účinku) u stovek běžně používaných léků, včetně např. glukokortikoidů. Třezalka tečkovaná je přímo u řady DAA preparátů kontraindikovaná.

Obrázek 2: Třezalka tečkovaná Hypericum perforatum
I jiná fytofarmaka mají indukční nebo inhibiční aktivitu na CYP3A4 a P glykoprotein. Nedoporučuje se souběžné podávání léků z těchto rostlin:
- jinan dvoulaločný Ginkgo biloba
- kurkuma dlouhá Curcuma longa
- lékořice lysá Glycyrrhiza glabra
- máta peprná Mentha piperita
- rdesno hlavaté Polygonum capitatum
- sója luštinatá Glycine max
- šalvěj červenokořenná Salvia miltiorrhiza
- třapatka nachová Echinacea purpurea
- ženšen pravý Panax ginseng.
- klanopraška čínská Schizandra chinensis
- pepř černý Piper nigrum
- šišák bajkalský Scutellaria baicalensis.
8.2. Koinfekce HBV
V průběhu léčby DAA preparáty může dojít k reaktivaci současně probíhající HBV infekce, která může být i život ohrožující a nasazení antivirové léčby nukleos(t)idovými analogy (NA) až při vzniklé HBV reaktivaci již nemusí mít efekt, což vede k další progresi jaterní dekompenzace a jsou případy, kdy bylo nutné indikovat transplantaci jater. Před nasazením DAA preparátů je tedy nutné vyšetřit sérologii na hepatitidu B a při pozitivitě postupovat následovně:
- Pokud pacient splňuje kritéria pro léčbu HBV infekce, tak nasadit NA.
- U HBsAg pozitivních pacientů, kde není indikováno nasazení antivirové léčby, třeba nasadit NA profylaxi a to v celém průběhu léčby DAA preparáty a v této profylaxi pokračovat ještě 12 týdnů po jejím ukončení. - U pacientů, kteří jsou HBsAg negativní a anti-HBc IgG pozitivní, je nutno v průběhu DAA léčby monitorovat, zda k HBV reaktivaci nedojde a při prvních známkách HBV reaktivace NA profylaxi ihned nasadit (EASL Guidelines HBV 2017).
- U pacientů, kteří jsou HBsAg negativní a anti-HBc IgG pozitivní, je nutno v průběhu DAA léčby monitorovat, zda k HBV reaktivaci nedojde a při prvních známkách HBV reaktivace NA profylaxi ihned nasadit (EASL Guidelines HBV 2017).
8.3. Dekompenzovaná cirhóza jater
Pacienti s dekompenzovanou cirhózu jater (Child-Pugh B nebo C) by měli být léčeni v centrech, která mají s DAA léčbou nejen velké zkušenosti, ale takové centrum musí mít i dobrou dostupnost k případnému provedení jaterní transplantace. Během léčby těchto pacientů je nutné její pečlivé monitorování a v případech zhoršující se jaterní dekompenzace je nutné její včasné ukončení. Pacienti s dekompenzovanou CIH (Child-Pugh B nebo C) bez HCC, čekající na transplantaci jater s MELD skóre <18-20 by měli nejdříve podstoupit léčbu a teprve potom transplantaci jater. U pacientů s dekompenzovanou CIH (Child-Pugh B nebo C) jsou kontraindikované režimy s proteázovými inhibitory. [5]
8.4. Renální insuficience
U lehkého až středně těžkého renálního postižení (glomerulární filtrace eGFR ≥30 ml/min/1,73 m2) není třeba v doporučených režimech s DAA preparáty provádět žádné úpravy. U pacientů se závažným renálním postižením nebo u pacientů hemodialyzovaných je nutné používat léčebné režimy bez sofosbuviru. [5]
8.5. Rezistence HCV k antivirotikům
Existují HCV populace, které mohou být k antivirové léčbě rezistentní. Klinicky významné jsou substituce (polymorfismy) oblasti NS5A viru HC, které jsou asociované s rezistencí a označujeme je jako RAS (Resistance Associated Substitution) nebo RAV (Resistance Associated Variant). Klinicky nejvýznamnější jsou tři RAS a třeba na ně myslet při léčbě inhibitory NS5A u HCV infekce způsobené genotypem 1a nebo genotypem 3, což může vést k špatnému efektu antivirové léčby:
- Při léčbě HCV infekce způsobené genotypem 1a přípravkem HarvoniTM (sofosbuvir+ledipasvir) může být rezistence na ledispavir
- Při léčbě HCV infekce způsobené genotypem 1a přípravkem ZepatierTM (grazoprevir+elbasvir) může být rezistence na elbasvir (tuto RAS doporučeno vyšetřovat pouze při virémii HCV RNA >800 000 IU/ml)
- Při léčbě HCV infekce způsobené genotypem 3 přípravkem EpclusaTM (sofosbuvir+velpatasvir) může být rezistence na velpatasvir.
Vyšetření na polymorfismy NS5A provádí: Laboratoř molekulární biologie a genetiky (vedoucí laboratoře Mgr. Scheinost), Nemocnice České Budějovice, a.s., B. Němcové 54, 370 01 České Budějovice. Kontaktní osoba: Mgr. Pavel Trubač – tel.: 387 873 021, trubac@nemcb.cz
8.6. Péče o pacienty po dosažení SVR
Po dosažení SVR je nutno u pacientů s METAVIR skóre F3 a F4 provádět po 6 měsících ultrasonografii břicha jako surveillance HCC. Současně je možné vyšetřovat i α-1-fetoprotein v séru, ale povinné to není.
Monitorování regrese fibrotických změn v játrech po dosažení SVR se zatím běžně neprovádí, ale nedá se vyloučit, že se to v budoucnu změní. Bylo totiž zjištěno, že po IFN-free léčbě nedojde pouze k zastavení další progrese jaterního onemocnění v důsledku eliminace HCV RNA, ale může dojít i ke zlepšení (mírnému ústupu) již existujících fibrotických změn v játrech.
Pacienti, kteří po dosažení SVR zůstávají v riziku, že budou znovu HCV infikováni, je doporučeno vyšetřovat 1× za rok HCV RNA.
V rámci péče o pacienty s chronickou HCV infekcí nelze opomenout, že tito pacienti by měli být očkováni proti virové hepatitidě A, pokud ji neprodělali (mají anti-HAV IgG negativní) a proti virové hepatitidě B očkovat séronegativní pacienty (tj. HBsAg, anti-HBc total a anti-HBs negativní).
Závěr
Z uvedeného je zřejmé, že DAA představují nevídanou revoluci v léčbě. DAA jsou vysoce účinná a bezpečná. Přestože nežádoucí účinky jsou vzácné, je nutné o nich vědět, respektovat kontraindikace a rozumět vedení léčby.
Literatura
- Chlíbek R, Smetana J, Šošovičková R et al. Výsledky séroprevalenční studie HCV infekce u dospělých v ČR. Hradecké virologické dny, Hradec Králové, 12.-13. 10. 2016
- Urbánek P, Husa P, Šperl J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Klin mikrobiol inf lék. 2017;23(1):22-40
- EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-398
- EASL Recommendation on Treatment of Hepatitis C 2018. J Hepatol. 2018;69(2):461-511
- Bedossa P, Poynard T. A algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology. 1996;24:289-293
- Urbánek P. Hepatitida C. 1. vyd. Praha: Mladá fronta 2017, 359 s.
- Castera L, Forns X, Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol. 2008;48(5):835-847
- Hůlek P, Urbánek P et al. Hepatologie. 3. vyd. Praha: Grada Publishing 2018, 738 s.
- Kamath PS, Wiesner RH, Malinchoc M, et al. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001;33(2):464-470
- PaperWiesner R, United Network for Organ Sharing Liver Disease Severity Score Committee, et al. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003;124(1):91-96
- Kremers WK, van IJperen M, Kim WR, et al. MELD score as a predictor of pretransplant and posttransplant survival in OPTN/UNOS status 1 patients. Hepatology. 2004;39(3):764-769
- Kamath PS, Kim WR. Advanced Liver Disease Study Group. The model for end-stage liver disease (MELD). Hepatology. 2007;45(3):797-805
- McDiarmid SV, Anand R, Lindblad AS. Principal Investigators and Institutions of the Studies of Pediatric Liver Transplantation (SPLIT) Research Group. Development of a pediatric end-stage liver disease score to predict poor outcome in children awaiting liver transplantation. Transplantation. 2002;74(2):173-181
- Shinkai M, Ohhama Y, Take H, Fukuzato Y, Fujita S, Nishi T. Evaluation of the PELD risk score as a severity index of biliary atresia. J Pediatr Surg. 2003;38(7):1001-1004
- Dostálek M. Enzymatický systém cytochromu P450. Postgraduální medicína 2006;8(1):46–54