Mezioborové stanovisko k podávání rekonvalescentní plazmy u pacientů s covidem-19
Mezioborové stanovisko ČSARIM, STL, SIL a ČPFS ČLS JEP, 8. 3. 2021
![]()
Originální dokument PDF pod evidenčním číslem ČSARIM: 18/2021
Česká společnost anesteziologie, resuscitace a intenzivní medicíny (ČSARIM) ČLS JEP
Společnost pro transfuzní lékařství (STL) ČLS JEP
Společnost infekčního lékařství (SIL) ČLS JEP
Česká pneumologická a ftizeologická společnost (ČPFS) ČLS JEP
V souvislosti s nárůstem počtu pacientů covid-19, kterým je v ČR podávána rekonvalescentní plazma (RP) při léčbě onemocnění covid-19 (k 31. 1. 2021 cca 4000 pacientů – nepublikovaná data), při existenci vysoké variability indikací k podávání RP mezi jednotlivými pracovišti a na základě aktuálního stavu odborného poznání o přínosu podávání RP u pacientů covid-19 formulují ČSARIM, STL, SIL a ČPFS následující stanovisko:
| 1. |
Podání RP lze zvážit u pacientů s prokázaným onemocněním covid-19 bez nutnosti
oxygenoterapie nebo u pacientů na oxygenoterapii s nízkým průtokem kyslíku do 3 dnů od
vzniku klinických příznaků a současně s negativním výsledkem imunologického testu na
stanovení IgG anti-SARS-CoV-2 protilátek. Podání RP nelze považovat za standardní
součást náležitě odborné péče v léčbě pacientů s covidem-19.
Pozn.: Podle všech aktuálních mezinárodních doporučení je podání RP u pacientů s covidem-19 doporučováno pouze tehdy, jsou-li zařazeni do klinických studií odsouhlasených etickou komisí. |
|
| 2. | Stávající stav odborného poznání naznačuje možnost příznivého efektu časného podání RP, analogicky jako u podávání monoklonálních protilátek. Z tohoto důvodu považujeme za možné i podávání RP pacientům s covidem-19 bez nutnosti hospitalizace. | |
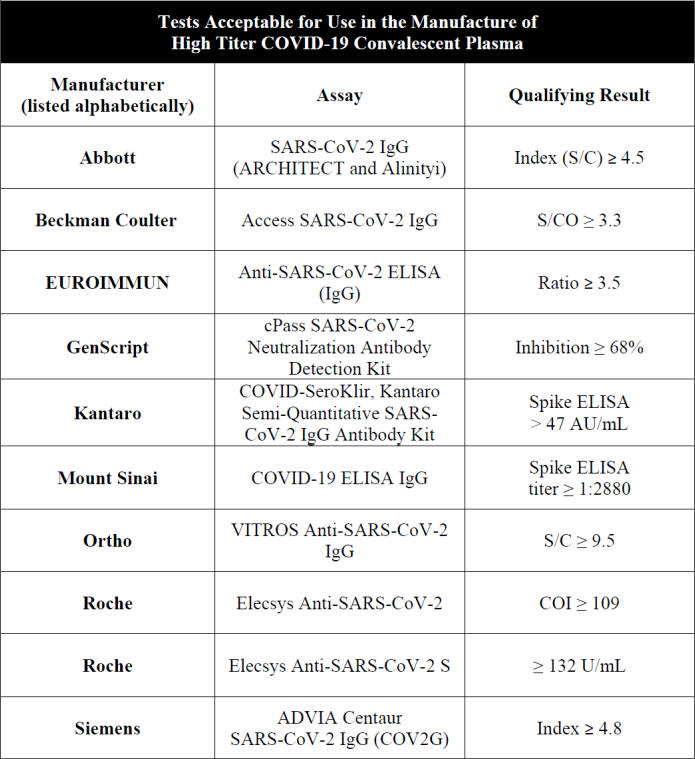
| 3. | Efekt RP je určen hodnotou titru tzv. virus neutralizačních protilátek, tj. čím je titr vyšší, tím lze očekávat lepší klinický/léčebný efekt. Aktivitu virus-neutralizačních protilátek lze stanovit virus neutralizačním testem (VNT) provedeným na tkáňové kultuře nebo sérologickými testy prokazujícími vazbu IgG protilátek na doménu virového spike-proteinu (anti-spike ectodomain) nebo na receptorový protein (receptor-binding protein) technikami ELISA, CLIA apod. Plazma by měla dosahovat titr minimálně 160 v testu VNT nebo hodnot podle aktuálního doporučení FDA pro jednotlivé sérologické testy (viz příloha 1 stanoviska). | |
| 4. | Léčebná dávka RP je obvykle 2 transfuzní jednotky, resp. 5-6 ml/kg. Při podání plazmy s vysokým obsahem protilátek je možné podat pouze jednu transfuzní jednotku. Pokud je k léčbě použita plazma s nízkým titrem protilátek, doporučuje se podat nejméně dvě transfuzní jednotky, a to od různých dárců. | |
Literatura
- Kraft CS, Hewlett AL, Koepsell S, et al. The Use of TKM-100802 and Convalescent Plasma in 2 Patients With Ebola Virus Disease in the United States. Clin Infect Dis. 2015;61(4):496-502. doi: 10.1093/cid/civ334.
- European Commision. An EU Programme of COVID-19 convalescent plasma collection and transfusion. Dostupné na: https://ec.europa.eu/health/sites/health/files/blood_tissues_organs/docs/guidance_plasma_covid19_en.pdf
- Stanovisko FDA k výrobě a použití rekonvaelscentní plazmy, 4.2.2021, dostupné na: https://www.fda.gov/media/141477/download
- Casadevall A, Dadachova E, Pirofski LA. Passive antibody therapy for infectious diseases. Nat Rev Microbiol. 2004;2(9):695-703. doi: 10.1038/nrmicro974. PMID.
- Use of Convalescent Whole Blood or Plasma Collected from Pacients Recovered from Ebola Virus Disease for Transfusion, as an Empirical Treatment during Outbreaks, WHO Interim Guidance for National Health Authorities and Blood Transfusion Services, Version 1.0, September 2014, WHO/HIS/SDS/2014.8
- Sahr F, Ansumana R, Massaquoi TA, et al. Evaluation of convalescent whole blood for treating Ebola Virus Disease in 257 Freetown, Sierra Leone. J Infect. 2017;74(3):302-9. doi: 10.1016/j.jinf.2016.11.009.
- Duan K, Liu B, Li C, Zhang H, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020;117(17):9490-96. doi: 10.1073/pnas.2004168117.
- Roback JD, Guarner J. Convalescent Plasma to Treat COVID-19: Possibilities and Challenges. JAMA. 2020;323(16):1561-2. doi: 10.1001/jama.2020.4940.
- Convalescent plasma associated with reduced COVID-19 mortality in 35,000-plus hospitalized patients, Mayo Clinic, dostupné na: https://newsnetwork.mayoclinic.org/discussion/convalescent-plasma-associated-withreduced-covid-19-mortality-in-35000-plus-hospitalized-patients/
- Joyner MJ, Wright RS, Fairweather D, et al. Early safety indicators of COVID-19 convalescent plasma in 5000 patients. J Clin Invest. 2020;130(9):4791-7. doi: 10.1172/JCI140200.
- Clinical management of COVID-19, Interim guindance 27 May 2020, WHO, dostupné na: https://www.who.int/publications/i/item/clinical-management-of-covid-19
- Libster R, Pérez Marc G, Wappner D, et al. Early High-Titer Plasma Therapy to Prevent Severe Covid-19 in Older Adults. N Engl J Med. 2021:NEJMoa2033700. doi: 10.1056/NEJMoa2033700.
Pracovní skupina (abecedně):
- Miloš Bohoněk (editor)
- Vladimír Černý (editor)
- Michal Holub
- Pavel Dlouhý
- Martina Vašáková
|
prof. MUDr. Vladimír Černý, Ph.D., FCCM, předseda výboru ČSARIM MUDr. Miloš Bohoněk, Ph.D. předseda výboru STL MUDr. Pavel Dlouhý, předseda výboru SIL prof. MUDr. Martina Vašáková, Ph.D., předsedkyně výboru ČPFS |
2. 3. 2021
Poznámka:
Mezioborové stanovisko je vydáno pod hlavičkou ČSARIM pouze z důvodu evidence
v systému ČSARIM a pro potřeby citovatelné reference jednotlivých odborných společností.
Váha odborného názoru participujících odborných společností je identická.
Příloha 1
Zdroj: Stanovisko FDA k výrobě a použití rekonvalescentní plazmy (k 23. 2. 2021), dostupné
zde: https://www.fda.gov/media/141477/download