|
Doporučený postup Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně

Verze pro tisk
Autoři:
Snopková S1, Rozsypal H2, Aster V2, Sedláček D3, Kapla J4, Jerhotová Z5, Olbrechtová L6, Zjevíková A6, Dlouhý P7, Jilich D8, Veselý D8
1 Klinika infekčních chorob FN Brno a LF MU Brno, pracoviště Bohunice, Jihlavská 25, Brno, 625 00
2 Klinika infekčních a tropických nemocí, 1. Lékařská fakulta, Univerzita Karlova v Praze a Nemocnice Na Bulovce, Budínova 2, Praha 8, 180 81
3 Infekční klinika, Fakultní nemocnice Plzeň, Dr. Beneše 13, Plzeň, 305 99
4 Klinika infekčních nemocí, Fakultní nemocnice Hradec Králové, Sokolská 581, Hradec Králové, 500 05
5 Infekční oddělení, Nemocnice České Budějovice, a.s. B. Němcové 54, České Budějovice, 370 01
6 Klinika infekčního lékařství, Fakultní nemocnice Ostrava, 17. Listopadu 1790, Ostrava-Poruba, 708 52
7 Infekční oddělení, Masarykova nemocnice v Ústí nad Labem, o.z., Ústí nad Labem, 401 13
8 Klinika infekčních, tropických a parazitárních nemocí, Nemocnice Na Bulovce, Budínova 2, Praha 8, 180 81
Odborný garant: Terapeutická skupina Národní komise pro řešení problematiky HIV/AIDS v ČR
Schváleno: výborem Společnosti infekčního lékařství 21. 1. 2016
Datum vydání: leden 2016
Verze: 1
Souhrn
V uvedeném textu jsou předkládány obecné principy postupu při přijetí člověka infikovaného HIV do péče AIDS centra, zahájení antiretrovirové léčby a dalšího sledování.
Vědecký výzkum, vývoj léčiv a nová klinická data během posledních let vedly ke změně některých terapeutických pohledů a preferencí při léčbě infekce HIV. Jsou lépe konkretizovány a specifikovány určité stavy, které ovlivňují výběr antiretrovirového režimu, jsou upřesněny postupy a kritéria při sledování efektu léčby a indikace postexpoziční profylaxe. Při tvorbě tohoto dokumentu jsme vycházeli z posledních aktualizací nejvýznamnějších doporučení světových i evropských. Jsou v něm reflektovány také některé nové vědecké informace, které byly publikovány v posledních měsících.
Obecná doporučení však nemohou postihnout vyčerpávajícím způsobem všechny možné alternativy. Uvádí pouze základní principy, vycházející z dosavadních klinických studií, klinického pozorování a praxe.
Předkládaný dokument by měl být základním informačním zdrojem pro lékaře, zabývající se léčbou pacientů s infekcí HIV, měl by poskytnout rychlou orientaci při sestavování léčebných režimů v intencích moderní farmakoterapie, stejně tak orientaci o úskalích této léčby. V neposlední řadě by měl být oporou pro jednání odborné společnosti se státními orgány a s plátci zdravotní péče.
Tato aktualizovaná verze doporučeného postupu strukturou navazuje na vydání z roku 2012 a stejně jako vydání minulé, je doplněna upraveným tabelárním přehledem.
Klíčová slova
infekce HIV – lidský virus imunodeficience (HIV) – antiretrovirová terapie (ART) – antiretrovirotika – plazmatická virémie - postexpoziční profylaxe (PEP)
Summary
This text presents the general principles of the procedure for the adoption of an infected person with HIV to AIDS care centre, initiating antiretroviral therapy and monitoring.
Scientific research, drug development and new clinical data in recent years have led to a change in certain therapeutic perspectives and preferences for the treatment of HIV infection.
Certain conditions are more conctretized and are specified which affect the choice of antiretroviral regimen, procedures and criteria are specified for monitoring the effect of treatment and post-exposure prophylaxis indication. When creating this document, we started from last updates most prominent international and European recommendations. It is also reflected in some of the new scientific information that had been published in recent months.
General recommendations can not cover exhaustively all the possible alternatives. It presents only basic principles based on current clinical studies, clinical observation and practice.
The present document should be the basic source of information for physicians involved in the treatment of patients with HIV infection, should provide a quick reference when compiling treatment regimens in terms of modern pharmacotherapy, as well as the orientation of the pitfalls of this treatment. Finally, it should be a support for negotiation of the expert society with the state authorities and health care payers.
This updated version of the guidelines follows the edition 2012, as well as the past, it is complemented by a modified tabular overview.
Key words
HIV infection – Human Immunodeficiency Virus (HIV) – antiretroviral therapy (ART) – antiretroviral drugs - viraemia – post exposure prophylaxis (PEP)
Obsah
|
1. Úvod
2. Náplň vstupního a kontrolních vyšetření
3. Iniciální zhodnocení a doporučení
4. Indikace AR léčby
5. Volba antiretrovirových léků
5.1. Doporučené režimy
5.2. Alternativní a jiné režimy
5.3. Nedoporučené léčebné režimy a kombinace antiretrovirotik
6. Hodnocení efektu, adherence a nežádoucích účinků ART
6.1. Hodnocení efektu léčby a adherence
6.2. Cíle efektivní ART
6.3. Hodnocení nežádoucích účinků ART
7. Změna kombinace ART
7.1. Změna kombinace ART při virologické supresi
7.2. Změna kombinace ART při virologickém selhání
8. Antiretrovirová léčba za specifických okolností
8.1. Těhotenství
8.2. Virové hepatitidy
8.3. Onemocnění ledvin
8.4. Dyslipidemie
8.5. Jiné komorbidity a koinfekce
9. Postexpoziční profylaxe infekce HIV
9.1. Profesionální expozice a akcidentální neprofesionální poranění s kontaminací HIV
9.2. Koitální expozice
Zkratky
Literatura
Tabelární příloha
|
Tabulky:
- Laboratorní testy a pomocná rutinní vyšetření
- Konziliární vyšetření
- Klinické situace ovlivňující výběr AR režimu
- Doporučený harmonogram laboratorních kontrol při indikaci PEP
- Použití hypolipidemik u pacientů léčených antiretrovirotiky
- Přehled nukleosidových a nukleotidových inhibitorů reverzní transkriptasy
- Přehled nenukleosidových inhibitorů reverzní transkriptasy
- Přehled inhibitorů proteinasy
- Přehled inhibitorů integrázy
- Přehled inhibitorů vstupu - inhibitor fúze a antagonista CCR5
- Interakce na úrovni jaterních cytochromových enzymů
- Fixní kombinace více léčiv v jedné tabletě
- Úprava dávkování antiretrovirotik u nedostatečnosti ledvin
1. Úvod
Účinná léčba nákazy lidským virem imunodeficience (Human Immunodeficiency Virus, HIV) byla zavedena do klinické praxe v roce 1996. V následujících letech došlo k dramatickému snížení morbidity i mortality a zásadně se změnil charakter nemoci. Dnes je toto onemocnění považováno za léčitelnou chronickou chorobu, vyvíjející se řadu desítek let. Podle Světové zdravotnické organizace (World Health Organization, WHO) je efektivní antiretrovirová terapie (ART) chápána nejen jako strategie terapeutická, ale také jako strategie prevence přenosu infekce HIV [1,2,3].
Přes veškeré pokroky moderní medicíny a farmakoterapie se infekce HIV šíří dál a vysoké procento nakažených je diagnostikováno ve velmi pokročilém stadiu selhání imunity, kdy je zatíženo extrémní morbiditou i mortalitou.
Nová léčiva s novými mechanismy účinku vykazují lepší farmakokinetické i farmakodynamické vlastnosti, mají podstatně vyšší bezpečnost, výhodnější dávkování, jsou lépe tolerována a řada z nich je schopna udržet svoji aktivitu v přítomnosti některých rezistentních mutant virových izolátů [4].
Definitivní eradikaci HIV z lidského organismu však nedokáží ani nová léčiva. Již během nejčasnější fáze akutní infekce dochází v různých tkáňových kompartmentech ke vzniku relativně stabilního virového rezervoáru latentně infikovaných buněk s dlouhým poločasem, který je antiretrovirovými (AR) léčivy dosud nepostižitelný [5].
Cílem ART je snížení morbidity v důsledku infekce HIV, prodloužení délky života a zkvalitnění života infikovaného jedince, regenerace a ochrana imunologických funkcí, dosažení maximální hluboké suprese plazmatické virémie, prevence přenosu infekce HIV [1].
Uvedená doporučení reflektují nejaktuálnější poznatky o léčbě infekce HIV. Rychlý vědecký výzkum a vývoj nových léčiv, stejně jako nová klinická data, mohou v krátkém čase změnit či alespoň pozměnit terapeutický pohled a preference za určitých specifických klinických stavů a situací. Během několika posledních let je ve všech odborných zdrojích opakovaně zdůrazňováno, že konkrétní složení AR režimu pro konkrétního pacienta musí být sestavováno přísně individuálně, ve vztahu ke všem individuálním charakteristikám daného jedince, komorbiditám, vhodnosti, možným vedlejším nežádoucím účinkům a interakcím s konkomitantní léčbou atd. [1,6].
Obecná doporučení nemohou postihnout vyčerpávajícím způsobem všechny možné alternativy. Uvádí pouze základní postupy a principy, vycházející z dosavadních klinických studií, klinického pozorování a praxe.
2. Náplň vstupního a kontrolních vyšetření
Odpovídá kompletnímu internímu vyšetření, jehož nedílnou součástí je:
Anamnéza se zaměřením na
- pravděpodobný způsob přenosu, poslední negativní test na přítomnost protilátek anti-HIV, známky možné primoinfekce
- pohlavně přenosné nemoci
- dříve prodělaná závažná onemocnění, případně stávající onemocnění (včetně hepatitid, zejména u starších pacientů kardiovaskulární onemocnění, diabetes mellitus a další)
- psychické problémy (úzkost, depresi, suicidální myšlenky)
- očkování proti tetanu, proti virovým hepatitidám
- škodlivé návyky - kouření, alkohol, drogy
- opakovaná ambulantní kontrola zahrnuje i otázky na aktuální psychický a somatický stav, nežádoucí účinky léčby – neuropsychiatrické příznaky, gastrointestinální příznaky, alergické projevy, adherenci (kolikrát pacient vynechal léky za poslední měsíc) atd.
Objektivní vyšetření obsahuje celkový fyzikální nález včetně antropometrických parametrů (výška, váha, body mass index) a změření krevního tlaku, tepové frekvence a teploty [7].
Základní rozsah a frekvenci laboratorních a pomocných vyšetření uvádí tabulka 1.
Navrhovanou frekvenci vyšetření přizvanými specialisty uvádí tabulka 2.
Další laboratorní a klinická vyšetření a jejich frekvence jsou indikována na základě klinického stavu pacienta (markery nutrice, screening metabolických onemocnění včetně kostní denzitometrie, onkologický screening, nefrologické, kardiologické, neurologické, psychiatrické vyšetření atd.).
3. Iniciální zhodnocení a doporučení
Výsledkem vyšetření je zhodnocení celkového stavu, stupně imunodeficitu, naléhavosti antiretrovirové léčby a profylaxe oportunních infekcí a dalších postupů. V dokumentaci musí být uvedeno, že byl pacient informován o stavu, možnostech léčby a potřebě protiepidemických opatření. Musí být vyzván k vyšetření sexuálního partnera/ partnerky. Po první návštěvě se posílá hlášení Národní referenční laboratoři pro AIDS. Přesná formulace diagnostického závěru a doporučení slouží k sdělení výstižné a spolehlivé informace ostatním lékařům a přispívá k racionálnímu vedení léčby [7].
Diagnostický závěr musí obsahovat upřesňující údaje o
- trvání pozitivity HIV – alespoň rok diagnózy (např. „diagnostikovaná II/07“)
- klinickém a laboratorním stadiu dle CDC 1993, popř. dle WHO 2007, u AIDS definující diagnózu (např. „A3“ nebo „C3 pro pneumocystovou pneumonii IX/08“)
- vývoji počtu CD4+ lymfocytů (iniciální – [nadir –] poslední: např. „CD4+ 55..20..170/μl“)
- aktuální virové náloži HIV (např. „VL HIV 38 000 kopií/ml“)
- dosavadní léčbě (např. „ART od …“ nebo „bez ART“), případně stručné zhodnocení adherence (např. „užívá nespolehlivě, opakované svévolné přerušení léčby“)
- aktuální komplikaci (např. „orofaryngeální kandidóza“)
- důležité komorbiditě (např. „syphilis latens recens“, „chronická hepatitida C“, „dyslipidemie“)
- dalších stavech ovlivňujících prognózu, výběr léčby apod. (např. „alergie na …“, „syndrom závislosti na pervitinu“).
V doporučení je nutné vyjádřit se k
- antiretrovirové léčbě
- profylaxi oportunních infekcí (např. „profylaxe oportunních infekcí není indikovaná“)
- vakcinaci, kterou je nutné doplnit, naléhavě doporučit, výhledově doplnit (upravuje samostatný doporučený postup [4])
- životosprávě – abstinenci alkoholu, drog …
- poučení o bezpečnějším sexu, o významu adherence, o režimových omezeních atd.
Je třeba explicitně uvést „Poučení podepsal(a), hlášení odesláno“, aby se předešlo nedorozuměním a následným duplicitním krokům.
Při předávání pacienta do péče jiného AIDS centra se uvádí mj. zejména
- předchozí použitá antiretrovirotika a vyšetření rezistence
- nesnášenlivost či alergie na použitá léčiva
- předchozí léčba interferonem
- předchozí léčba syfilidy
- případnou neefektivní vvakcinaci proti hepatitidám (non-responder)
- zjištěný haplotyp HLA B*57:01,
aby se zbytečně neopakovala vyšetření a léčebné postupy [7].
4. Indikace AR léčby
Antiretrovirová léčba je doporučena pro všechny osoby infikované HIV ke snížení rizika progrese nemoci a k prevenci dalšího přenosu infekce HIV [1,2,3].
Primárním cílem ART je snížení vysoké morbidity a mortality následkem infekce HIV. Maximální inhibice replikace HIV vede k virové supresi s počtem kopií RNA HIV-1 pod hladinu detekovatelnosti v plazmě a k regeneraci imunologických funkcí infikovaného jedince. Klinickým důsledkem je zlepšení kvality života, prodloužení života a signifikantně nižší riziko vzniku AIDS-definujících, ale také non-AIDS-definujících nemocí a stavů.
Míra regenerace imunitního systému a počtu CD4+ lymfocytů je v přímé korelaci s počtem CD4+ lymfocytů v době zahájení ART. Vysoký počet infikovaných, u kterých je zahájena ART při počtu CD4+ lymfocytů <350/μl ani po několika letech léčby nedosáhne počtu >500/μl. Neléčená infekce HIV s nekontrolovanou virémií nekompromisně vede k fatální fázi AIDS a přesvědčivě narůstá důkazů, že má za následek také signifikantně vyšší výskyt non-AIDS-definujících nemocí jako jsou kardiovaskulární komplikace, onemocnění ledvin, jater, neurologické komplikace a vyšší výskyt malignit [1,3].
Kritéria pro zahájení ART byla na základě observačních studií během let posouvána do časnějších stádií. Jednotlivá doporučení se však opírala o různě kvalitní studie a všeobecný názor nebyl zcela konzistentní. Jednoznačnou odpověď dala až multicentrická randomizovaná studie Strategic Timing of Antiretroviral Therapy (START) l. Studie statisticky prokázala jednoznačný benefit z časného zahájení ART i u pacientů asymptomatických, s vysokým absolutním počtem CD4+ lymfocytů >500 buněk/μl, a to jak v četnosti AIDS-definujících onemocnění, tak non-AIDS-definujících onemocnění. Nebyla zaznamenána ani vyšší míra nežádoucích účinků spojených s ART [9].
Na druhé straně je třeba vzít v úvahu, že vedlejší účinky ART při dlouhodobém (celoživotním) užívání léčiv nejsou dostatečně definované a nemáme zatím k dispozici náležité množství relevantních údajů exaktně objasňujících tyto sekundární fenomény.
Obecné podmínky pro zahájení léčby:
Před zahájením ART je nutné
- vyšetřit absolutní počet CD4+ lymfocytů, nehrozí-li nebezpečí z prodlení, je vhodné provést konfirmační vyšetření s odstupem několika týdnů
- vyšetřit počet kopií RNA HIV-1 /ml plazmy
- zahájit profylaxi oportunních infekcí u pacientů s těžkým imunodeficitem (absolutní počet CD4+ lymfocytů <200/μl)
- vysvětlit důležitost léčby a význam adherence
- zhodnotit momentální dostupnost konkrétních léků na trhu.
Speciální podmínky pro zahájení léčby:
Před zahájením ART konkrétními léčivy a u pacientů s významnou komorbiditou musí být splněna některá další kritéria. Musí být k dispozici
- vyšetření HLA B*57:01 při volbě ABC
- vyšetření HIV-1 R5 tropismu při volbě MVC
- případná antituberkulózní léčba podávaná
při absolutním počtu CD4+ lymfocytů ≤100/μl: >2 týdny
při absolutním počtu CD4+ lymfocytů 100-350/μl: >8 týdnů
(vzhledem k možné progresi manifestní či reaktivaci latentní tuberkulózy
v rámci syndromu imunitní obnovy [IRIS]) [7].
- myelosupresi způsobující léčiva užívaná u oportunních infekcí (mohou imitovat různé typy dřeňových útlumů coby důsledku pokročilé HIV infekce)
Akceptovatelná prodleva:
ART se obecně zahajuje po splnění výše uvedených podmínek. U oportunních infekcí, u nichž dosud neznáme kauzální léčbu (např. kryptosporidióza, mikrosporidióza, progresivní multifokální leukoencefalopatie), je třeba ART zahájit promptně, aby se co možná nejrychleji regenerovala imunitní odpověď. U některých (např. kryptokoková meningitida) je vhodnější zahájit léčbu oportunní infekce a s ohledem na možný vznik těžkého syndromu imunitní obnovy (IRIS) ART iniciovat s odstupem několika týdnů [10].
Antiretrovirotika podaná z indikace postexpoziční profylaxe a při pozdním záchytu infekce HIV před porodem se musí podat ihned, bez jakéhokoli prodlení, odklad zahájení léčby řádově v hodinách významně snižuje účinnost profylaxe [7].
Použití antiretrovirotik při hrozícím riziku infekce HIV:
Profylaxe vertikálního přenosu a postexpoziční profylaxe jsou řešeny samostatně.
5. Volba antiretrovirových léků
Antiretrovirový režim spočívá v kombinaci nejméně tří virostatik s AR aktivitou nejméně ze dvou různých skupin. Nové AR režimy jsou efektivnější, bezpečnější a jsou podstatně lépe tolerovány, než režimy starší. Obecně je doporučováno tam, kde je to možné, přednostně volit fixní kombinaci několika léčiv v jedné tabletě [1].
ART je v současné době jednoznačně chápána a akceptována jako léčba celoživotní.
5.1. Doporučené režimy
Prokázaná vysoká efektivita, excelentní bezpečnostní profil, minimum nežádoucích účinků a velmi dobrá tolerance INSTI jednoznačně vedly k tomu, že tyto režimy zaujaly prioritní pozici v léčbě infekce HIV. RAL a DTG nemají žádné signifikantní interakce na enzymatickém systému CYP 3A4, což je činí vysoce bezpečnými i při bohaté konkomitantní medikaci [1,3].
Proteázový inhibitor DRV potencovaný RTV má vysokou genetickou rezistenční bariéru a je doporučován pro pacienty, u kterých je nebezpečí nižší adherence [1].
Složení AR kombinace lze vyjádřit vzorcem:
([1 NRTI + 1 NtRTI] nebo 2 NRTI) + (INSTI nebo PI/r)
- NtRTI: TDF, TAF
- NRTI: ABC, FTC, 3TC
- INSTI: DTG, EVG/c, RAL
- PI/r: DRV/r.
Fixní kombinace několika léčiv v jedné tabletě: - TDF/FTC
- ABC/3TC
- EVG/cobi/TDF/FTC
- EVG/cobi/TAF/FTC
- DTG/ABC/3TC.
5.2. Alternativní a jiné režimy
Alternativní a jiné režimy jsou takové, které mají určité potenciální nevýhody nebo je o jejich účinku při určitých situacích k dispozici méně dat z klinických studií. Za jistých okolností v závislosti na individuálních charakteristikách pacienta a potřeby, může být alternativní režim pro konkrétního pacienta režimem preferovaným a optimálním [1,3].
Složení AR kombinace vyšší volby lze vyjádřit vzorcem:
([1 NRTI + 1 NtRTI] nebo 2 NRTI) + (NNRTI nebo PI/r nebo EI)
- NRTI: ZDV
- NNRTI: EFV, RPV, ETV, NVP
- PI/r: ATV/r, LPV/r, DRV/cobi
- EI: MVC
Fixní kombinace několika léčiv v jedné tabletě: - 3TC/ZDV
- LPV/r
- DRV/cobi
- EFV/TDF/FTC
- RPV/TDF/FTC
Výše uvedené doporučované a alternativní režimy jsou tvořeny 2 NRTI nebo 1 NRTI + 1 NtRTI a třetím aktivním léčivem z jiné volitelné skupiny [1,3,11]. Tato strategie ale nemusí být vhodná a optimální pro všechny pacienty. V některých případech nelze podávat TDF ani ABC. To platí zejména u pacientů s preexistujícím renálním postižením, s pozitivní alelou HLA B*5701, s vysokým kardiovaskulárním rizikem atd. Proto jsou některé iniciální (tzv. NRTI-šetřící) režimy sestavovány bez TDF a ABC nebo obecně bez jakéhokoli antiretrovirotika ze skupiny NRTI či NtRTI [1,11].
Účinnost a efektivita těchto kombinací zejména z dlouhodobého hlediska není zatím podepřena dostatečným počtem validních klinických studií. Měly by být určeny výhradně pro pacienty, u nichž jsou zásadní kontraindikace podání NRTI nebo NtRTI. Za striktně stanovených podmínek jsou přípustné kombinace:
- LPV/r + RAL
- LPV/r + 3TC
- DRV/r + RAL (při absolutním počtu CD4+ lymfocytů >200/μl a současném počtu RNA HIV-1 <100 000 kopií/ml)
Monoterapie není obecně doporučována [1,3].
Vznik rezistence, částečné rezistence, toxicita, intolerance či jiné nežádoucí účinky mohou významně zúžit počet možných a vhodných léčiv do troj či vícekombinačních režimů. V takových mezních situacích je lékař nucen preferovat nekonvenční kombinace, které nelze vždy predikovat. Nezbytnou podmínkou je velmi pečlivé sledování účinku nejen z hlediska virové suprese, ale také možných sekundárních nežádoucích jevů konkrétní léčebné kombinace.
Antivirotika didanosin, stavudin, zidovudin, delavirdin, nelfinavir, indinavir, saquinavir a tipranavir již nejsou k léčbě infekce HIV v ekonomicky vyspělých zemích doporučována.
Enfuvirtid je třeba podávat subkutánně ve dvou denních dávkách. Pro tuto nevýhodnou formu aplikace platí v současné době všeobecný koncensus nahradit enfuvirtid v léčebných režimech jiným léčivem, které má komfortnější způsob podání [12].
Při výběru léků se zohledňuje:
- předpokládaná dobrá tolerance
- dávkování (preferované jsou fixní kombinace více léčiv a simplifikované režimy s nižším počtem tablet)
- neuroprotektivní efekt (sekundární prevence neurokognitivní poruchy vázané na infekci HIV [HIV-associated neurocognitive disorders, HAND]: z tohoto pohledu je vhodný dostatečný podíl AR léků s penetrací do CNS - dobrou [ABV, FTC, ZDV, NVP, LPV/r] nebo alespoň uspokojivou [3TC, d4T, EFV, DRV, ATV, FPV])
- poruchy tukového metabolizmu před léčbou (z PI méně vhodné LPV/r, FPV, SQV)
- psychické poruchy (nevhodný EFV)
- hepatopatie (nevhodný NVP, méně vhodné PI)
- nefropatie (nevhodný TDF a léčiva potencovaná cobicistatem)
- periferní neuropatie (nevhodný ddI, d4T)
- anémie nebo současné podání hematotoxických léků (nevhodný ZDV)
- alergie na sulfonamidy (nevhodný TPV) atd. [7].
5.3. Nedoporučené léčebné režimy a kombinace antiretrovirotik
Nepodávají se monoterapie NRTI, dvojkombinace NRTI, trojkombinace NRTI, dvojkombinace NNRTI.
Rovněž se nepodávají tyto kombinace:
- ATV + IDV
- ddI + d4T
- ddI + TDF
- FTC + 3TC
- d4T + ZDV
- ETV + PI (nepotencovaný RTV)
- ETV + ATV/r
- ETV + FPV/r
- ETV + TPV/r
- v kombinacích nepotencovaný DRV, SQV, TPV [1].
Přehled některých klinických situací, ovlivňujících výběr AR režimu uvádí tabulka 3.
6. Hodnocení efektu, adherence a nežádoucích účinků ART
6.1. Hodnocení efektu léčby a adherence
Za nejdůležitější parametr, hodnotící odpověď na ART a efekt ART, je v současné době považována plazmatická virémie (počet kopií RNA HIV-1/ml) a dosažení konstantní virové suprese. Informace o počtu CD4+ lymfocytů má zásadní význam v době zahájení pravidelného sledování pacienta k určení naléhavosti ART a profylaxe oportunních infekcí. Po nasazení ART monitoring CD4+ lymfocytů indikuje vhodnou dobu přerušení a ukončení profylaxe oportunních infekcí. U stabilizovaných pacientů význam systematického stanovování absolutního počtu CD4+ lymfocytů ustupuje do pozadí a sledování jiných subpopulací CD lymfocytů (např. CD8 nebo CD19) se momentálně rutinně nedoporučuje [1,13].
6.2. Cíle efektivní ART
Cílem efektivní ART je dosažení: - za 3 měsíce po zahájení ART - počet kopií RNA HIV-1 <400 /ml
- za 6 měsíců po zahájení ART - počet kopií RNA HIV-1 pod hladinou detekovatelnosti
Pokud má pacient dobrou adherenci k léčbě, udržuje konstantní virovou supresi pod hladinou detekovatelnosti počtu kopií RNA HIV-1 po dobu více než 2 roky, má absolutní počet CD4+ lymfocytů >300/μl a je klinicky i imunologicky stabilizován jsou akceptovatelné 6-ti měsíční intervaly dalšího pravidelného monitorování [1].
6.3. Hodnocení nežádoucích účinků ART
Časné nežádoucí účinky, tj. do 4-6 týdnů,se zhodnotí na základě: anamnézy, fyzikálního vyšetření, laboratorních testů: KO, natrium, kalium, chloridy, urea, kreatinin, cystatin C, CKD-EPI (nebo MDRD), bilirubin, ALT, AST, GGT, ALP, amyláza, glykémie, známky hypersenzitivního syndromu při léčbě ABC.
Pozdní nežádoucí účinky, tj. za >6 týdnů, se projeví v klinickém nálezu a odběrech za 3, 6 a více měsíců: laboratorní testy: KO+dif, natrium, kalium, chloridy, urea, kreatinin, cystatin C, CKD-EPI (nebo MDRD), bilirubin, ALT, AST, GGT, ALP, amyláza, glykémie, CRP, frakce krevních lipidů, B2M, LDH, laktát. Morfologické a/nebo antropometrické známky lipodystrofie. Ukončení léčby ATV je indikováno při opakovaném zvýšení aminotransferás nebo bilirubinémie >90 μmol/l [7].
7. Změna kombinace ART
7.1. Změna kombinace ART při virologické supresi
Virologická suprese je laboratorně potvrzený počet kopií RNA HIV-1 v plazmě pod hladinou detekovatelnosti.
Při konstantně udržované hluboké supresi replikace HIV s počtem kopií RNA HIV-1 pod hladinou detekovatelnosti je vznik rezistentních mutací velmi málo pravděpodobný nebo minimální.
Indikace ke změně léčebné kombinace: Ke změně léčby vedou některé okolnosti, jako
- toxicita stávajících léčiv
- potenciál k závažným lékovým interakcím
- nežádoucí účinky
- plánování těhotenství
- prevence dlouhodobé toxicity (tzv. pre-emptive switch)
- stárnutí a/nebo komorbidity s možným negativním ovlivněním stávajících léčiv (kardiovaskulární onemocnění, změny metabolických parametrů a další)
- simplifikace antiretrovirového režimu
- dosavadní režim není dále doporučován
Absolutní podmínkou je udržení (zachování) virové suprese. Změna AR režimu při virové supresi je obecně bezpečná, pokud známe a bereme v úvahu předchozí léčbu a rezistenční profil. Jestliže měníme AR režim s potencovaným PI (což je režim s vysokou rezistenční bariérou) na režim s nižší rezistenční bariérou, je nutná plně aktivní kombinace 2 NRTI nebo 1 NRTI + 1 NtRTI [1,3].
7.2. Změna kombinace ART při virologickém selhání
V hodnocení virologické odpovědi se rozlišují následující stavy:
- Virologické selhání je neschopnost dosáhnout suprese virové replikace vyjádřené počtem kopií RNA HIV-1 <200/ml plazmy. Persistující plazmatická virémie ≥200 kopií/ml je velmi často provázena zřetelnou virovou evolucí a akumulací rezistentních mutant. Proto je perzistující plazmatická virémie s počtem RNA HIV-1 ≥200 kopií/ml považována za virologické selhání.
- Nekompletní virologickou odpovědí se rozumí zastižení hodnot dvou po sobě následujících vyšetření počtu kopií RNA HIV-1 ≥200/ml plazmy zjištěná po 24 týdnech užívání ART. Výchozí plazmatická virémie (počet kopií RNA HIV-1), při níž je zahájena ART, může ovlivnit dobu, potřebnou k navození virologické odpovědi. Některé režimy jsou schopny navodit virovou supresi rychleji než jiné.
- Virologický „rebound“ je laboratorně potvrzený počet kopií RNA HIV-1 ≥200/ml plazmy následující po virologické supresi.
- Virologický „blip“ je izolovaná detekce RNA HIV-1 v plazmě po virologické supresi, která je následována spontánním návratem k virologické supresi.
Po vyloučení non-adherence, vytvoření přehledu dosavadní léčby, obdržení výsledku testování rezistence co nejdříve následuje změna léčby.
Změna kombinace ART má zabránit progresivní akumulaci rezistentních virových mutant. Některé studie naznačují, že virologická odpověď na nové AR režimy je robustnější u jedinců, kteří mají v době změny režimu nižší plazmatickou virémii RNA HIV-1 a vyšší počet CD4+ lymfocytů.
Ve stávajícím režimu je podle výsledku rezistence třeba nahradit minimálně dva léky (lépe tři, eventuálně více) novými plně aktivními léčivy, ideálně z nových skupin antiretrovirotik. Při částečné rezistenci, pokud nejsou k dispozici léčiva plně aktivní, je třeba volit více léčiv částečně aktivních [1].
8. Antiretrovirová léčba za specifických okolností
8.1. Těhotenství
Indikace
Těhotenství u léčené HIV pozitivní ženy nutí pokračovat v ART a
u ženy s čerstvě diagnostikovanou infekcí HIV je důvodem pro zahájení ART.
Léčba se nabízí všem ženám, včetně těch s nízkou viremií HIV.
Hlavním cílem ART v těhotenství je vedle léčby ženy snižení rizika vertikálního přenosu HIV.
V zájmu dosažení nedetekovatelné nálože HIV v době porodu je žádoucí zahájit léčbu brzy po diagnóze a
potřebných vyšetřeních v kterémkoli stupni gravidity.
Podle doby stanovení diagnózy infekce HIV ve vztahu ke graviditě může nastat několik situací:
- před otěhotněním:
volí se obvyklý režim, žena ve fertilním věku nemá dostat EFV
- screeningem v prvním trimestru:
ART se zahájí po provedení potřebných vyšetření režimy popsanými níže, nejlépe v průběhu 2. trimestru
- druhém nebo třetím trimestru:
ART se zahájí co nejdříve, do kombinace se zařadí InSTI (RAL), které vedou k nejrychlejšímu snížení virémie HIV
- v průběhu porodu nebo až u novorozence:
novorozenci se zahájí ART okamžitě, alespoň ZDV v sirupu.
Volba režimu
Při volbě ART u gravidních je vedle účinnosti důležitým kritériem bezpečnost pro ženu, plod a dítě.
U žádného antiretrovirotika, dokonce ani u EFV, nebyl shledán signifikantně zvýšený výskyt malformací u člověka.
Za potenciálně škodlivé byly označeny nejpoužívanější zidovudin (srdeční vady), již nedoporučovaný
didanosin a indinavir (malformace hlavy a krku) a atazanavir (kožní a muskuloskeletální defekty).
Význam nižší kostní denzity novorozenců prenatálně vystavených působení tenofoviru nebyl zhodnocen
a není znám význam pro další vývoj dítěte.
Vzhledem k přednostem a nedostatkům jednotlivých léčiv pro těhotné jsou režimy
- preferované, resp. akceptovatelné:
- základ kombinace - NtRTI+NRTI, resp. 2 NRTI: TDF/FTC, ABV/3TC nebo i v minulosti nejvíce používaný a prověřený ZDV/3TC
- třetí složka trojkombinace:
PI: DRV/r, LPV/r
InSTI: RAL
- nedoporučované až nevhodné:
PI: ATV/r (určité nejasnosti v bezpečnosti, možná retardace intrauterinního růstu), ostatní PI (obecně více nedostatků a nežádoucích účinků)
NNRTI: ETV (málo informací)
InSTI: EVG, DTG (nejsou zkušenosti)
- kontraindikované:
- ddI + d4T – laktátová acidóza (mitochondriální toxicita) u gravidní ženy
- EFV v prvním trimestru – teratogenita (defekty neurální trubice u zvířat)
- NVP, zejména pokud je počet CD4 >250/μl (kožní reakce, Stevensův-Johnsonův syndrom).
Pokud není ve třetím trimestru a zejména před termínem porodu dosaženo nedetekovatelné virémie HIV, je vhodné
zvážit přidání InSTI (RAL) s přihlédnutím k výsledku stanovení rezistence HIV in vitro.
Defekty neurální trubice po expozici efavirenzu pozorované v pokusech na zvířatech se u člověka týkají
prvních osmi gestačních týdnů, kdy dochází k organogenezi. Z toho důvodu nemá smysl vysazovat
již podávaný efavirenz při zjištění gravidity a stačí soustředit se na vyloučení poškození plodu při
ultrazvukovém vyšetření v 18-20 týdnu.
Úprava dávkování
V graviditě se upravují dávky PI:
- LPV/r: 2× (600/150) mg/d
- DRV/r: 2× (800/100) mg/d
- ATV/r: 1× (400/100) mg/d
SQV, NFV a FPV standardní dávkování, pro TPV chybí údaje.
Sledování v graviditě
Kontroly v graviditě provádí
- praktický gynekolog: podle harmonogramu dispenzárních kontrol v těhotenství
- gynekolog-porodník: nejméně 34.-36. týden k určení způsobu a termínu porodu
- infektolog AIDS centra: obvykle 1×/ 2 měsíce.
Invazivní vyšetření (odběr choriových klků, amniocentéza) jsou v indikovaných případech přípustné při nedetekovatelné viremii HIV.
Porod
Porod HIV pozitivní ženy
- se má uskutečnit na specializovaném pracovišti (porodním sále Kliniky infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce v Praze, resp. na Gynekologicko-porodnické klinice Nemocnice Na Bulovce v Praze) nebo jiném pracovišti schopném péče o HIV pozitivní rodičku
- provází aplikace infuze zidovudinu (lze pominout, pokud je počet kopií RNA HIV-1 pod hladinou detekovatelnosti)
- přednostně se vede císařským řezem (lze pominout, pokud je počet kopií RNA HIV-1 pod hladinou detekovatelnosti a nejsou jiné, např. porodnické důvody)
- provádí se odběr pupečníkové krve za účelem vyloučení přítomnosti viru molekulárně genetickými metodami.
Po porodu se zastavuje laktace (antagonisty prolaktinu, obvykle carbegolinem), aby dítě nebylo kojeno.
Novorozenec HIV pozitivní matky
Vedle rutinní péče o novorozence se poskytuje
- antiretrovirotikum profylakticky - zidovudin v sirupu 8 mg/kg.d (2-4×/d), zahájí se za 6-12 hod. po narození, za 14 dní se dávka zvýší na 12 mg/kg.d, podává se po dobu 4 týdnů, při neúplné prenatální profylaxi 6 týdnů;
nedonošenému gestačního stáří <35 a ≥30 týdnů 4 mg/kg.d (2x/d) p.o. nebo 3 mg/kg.d (2x/d) i.v., za 14 dní 6 mg/kg.d p.o.;
nedonošenému gestačního stáří <30 týdnů počáteční dávky stejné, po 4 týdnech zvýšení na 6 mg/kg.d p.o.;
- umělá výživa.
Odběry materiálu se provádí ke kontrole nežádoucích účinků profylaxe a stanovení časné diagnózy případné infekce HIV
(VL HIV z pupečníkové krve, krevní obraz). V dalším vývoji je dítě perinatálně exponované infekci matky
sledováno až do vyloučení nákazy na základě negativního výsledku přímého průkazu viru z odběrů v 1, 3 a 6 měsících a
séronegativity protilátek anti-HIV v 18 měsících.
8.2. Virové hepatitidy
Vzhledem k rychlejší progresi jaterní nemoci je léčba virových hepatitid u HIV/HBV a HIV/HCV koinfikovaných osob preferována oproti HBV a HCV monoinfikované populaci.
Infekce HIV je jednoznačným faktorem, který je asociován s progresí jaterního postižení.
Podle nových doporučení se léčebné postupy virových hepatitid u HIV infikovaných osob v zásadě neliší od postupů užívaných u běžné populace.
8.2.1. Virová hepatitida B
V léčbě virové hepatitidy B u HIV koinfikovaných osob je základem anti-HBV léčby tenofovir, užívaný často v kombinaci s emtricitabinem, obě léčiva s duálním, tedy antiretrovirovým i anti-HBV účinkem.
Entecavir je přípustný jen u těch, kteří užívají kompletní antiretrovirový režim. Entecavir v monoterapii je pro HIV/HBV koinfikované zcela nevhodný vzhledem k jeho částečnému antiretrovirovému účinku a z toho vyplývajícímu riziku selekce HIV rezistentních mutant.
Pegylovaný interferon alfa-2a a adefovir jsou jedinými anti-HBV léky, které by bylo možné užít v monoterapii hepatitidy B. Připadalo by to v úvahu u HIV/HBV koinfikovaných osob, které z nějakého důvodu neužívají antiretrovirovou terapii.
Postup v léčbě virové hepatitidy B je popsán v doporučení České hepatologické společnosti ČLS JEP a Společnosti infekčního lékařství ČLS JEP [23].
8.2.2. Virová hepatitida C
Zásadním problémem a odlišností v léčbě virových hepatitid u HIV infikovaných osob je v současné době narůstající riziko vzniku lékových interakcí. Tento problém je aktuální zejména v léčbě virové hepatitidy C v důsledku nových možností přímo působícími antivirotiky (DAA).
S nástupem DAA v léčbě virové hepatitidy C je proto často nezbytné před zahájením anti-HCV terapie upravit antiretrovirový režim. Z hlediska rizika lékových interakcí při léčbě VHC jsou z antiretrovirotik nejbezpečnější inhibitory integrázy. Naopak inhibitory proteázy by měl obsahovat jen jeden léčebný režim (buď antiretrovirový nebo anti-HCV). Je rovněž nevhodné kombinovat tenofovir se sofosbuvirem vzhledem ke vzájemné potenciaci nefrotoxicity. Při volbě anti-HCV léčebného režimu u HIV/HCV koinfikovaných osob je vhodné konzultovat klinického farmakologa nebo využít programu, který se zabývá lékovými interakcemi a je dostupný na webových stránkách: www.hep-druginteractions.org.
Rychlý vývoj protivirových preparátů a velmi dynamická situace v možnostech léčby chronické VHC vyžaduje průběžné ověřování aktuálních možností léčby. Nerovnoměrné zavádění a dostupnost nových DAA v jednotlivých zemích do rutinní praxe může zásadně měnit anti-HCV léčebnou strategii a může být limitujícím faktorem užití optimálního postupu.
Léčebná schémata pro léčbu virové hepatitidy C vycházejí z doporučení Evropské asociace pro studium jater (EASL) a z doporučení České hepatologické společnosti ČLS JEP a Společnosti infekčního lékařství ČLS JEP [24,25].
8.3. Onemocnění ledvin
Renální onemocnění vyžadují zodpovědný výběr léků a případně úpravu jejich dávkování.
Úpravu dávkování antiretrovirotik u nedostatečnosti ledvin uvádí tabulka 12.
8.4. Dyslipidemie
Jak ukazují některé studie, HIV pozitivní populace je obecně ve zvýšeném riziku klinické manifestace kardiovaskulárního onemocnění v podstatně nižší věkové kategorii. Příčina je patrně multifaktoriální, jistou roli však může sehrávat i potenciál některých AR léčiv (zejména PI a starších NNRTI) k alteraci lipidového spektra.
Na významu nabývají preventivní opatření:
- změna životního stylu (dietní korekce, fyzické cvičení, normální body mass index [BMI], snížení konzumace alkoholu, zanechání kouření)
- modifikace AR režimu
- změna PI/r na NNRTI, RAL nebo jiný PI/r o němž je známo, že má menší potenciál k negativnímu ovlivnění metabolických parametrů
- změna d4T a zvážení změny ZDV nebo ABC na TDF
- změna stávajícího AR režimu na NRTI-šetřící režim.
Terapeutická intervence dyslipidémie by měla být zahájena u pacientů s cévním onemocněním, diabetem 2. typu, s vysokým kardiovaskulárním rizikem a vysokou hladinou krevních lipidů. Jako hypolipidemika první volby jsou doporučovány statiny.
Při léčbě hypolipidemiky a ART je třeba brát v úvahu možné lékové interakce na úrovni cytochromových enzymů, což zvyšuje riziko rabdomyolýzy, event. renální insuficience. Obecně je doporučováno zahájení terapie dávkou nižší, až při eventuálním nedostatečném efektu dávku zvýšit. Důležité je sledování klinického stavu a kontrola CK, LDH, myoglobinu a jaterních aminotransferas.
Simvastatin je při terapii ART kontraindikován [11]. Dávky hypolipidemik u pacientů léčených antiretrovirotiky jsou uvedeny v tabulce 5.
8.5. Jiné komorbidity a koinfekce
Téma je detailně rozebráno v EACS Guidelines. Version 8.0 - October 2015. On-line: http://www.europeanaidsclinicalsociety.org/.
9. Postexpoziční profylaxe infekce HIV
9.1. Profesionální expozice a akcidentální neprofesionální poranění s kontaminací HIV
Kontaminované poranění zdravotníků a podobné expozice HIV infikované krvi jsou za jistých okolností důvodem k podání postexpoziční profylaxe (PEP) infekce HIV. Pravděpodobnost přenosu HIV souvisí s typem expozice a množstvím viru přítomného v inokulu. Podle dat Centra pro kontrolu nemocí je odhadováno, že průměrné riziko přenosu HIV po profesionální perkutánní expozici je asi 0,3 % a žádný režim PEP nedokáže pravděpodobně zajistit absolutní ochranu před možnou nákazou.
Indikace
Bere se v úvahu:
- biologický materiál
- infekční: krev, tělní tekutiny (mozkomíšní mok, perikardiální, pleurální a synoviální tekutina, plodová voda), genitální sekrety (sperma, cervikovaginální sekret), mateřské mléko
- neinfekční: moč, výkaly, sliny, zvratky, nosní sekret, sputum, slzy, pot
- množství kontaminujícího materiálu
- vysoce rizikové: viditelná krev v duté jehle – riziko přenosu se zvyšuje s průměrem jehly (jehly k i.v. aplikaci, k bioptickému odběru tkání) nebo na chirurgickém nástroji
- méně rizikové: nepatrné množství krve na nástroji, jehla po i.m. nebo s.c. aplikaci
- povaha zranění
- vysoce rizikové: hluboký vpich nebo říznutí při operaci
- méně rizikové: škrábnutí, potřísnění neintaktní kůže
- potřísnění intaktní zdravé kůže nepředstavuje prakticky žádné riziko přenosu HIV
- stav zdrojové osoby
- vysoce rizikový: jistá infekce HIV neléčená (s vysokou plazmatickou virémií)
- méně rizikový: léčená (s předpokládanou nebo stanovenou nízkou nebo nedetekovatelnou plazmatickou virémií)
- možná infekce HIV: u osoby s neznámým statem a rizikovými faktory.
PEP indikována:
- u vysoce rizikového poranění od zdrojové osoby HIV-pozitivní nebo podezřelé z infekce (jakmile je tato osoba potvrzena jako HIV-negativní, není PEP dále indikována a lze ji bezpečně ukončit)
- u méně rizikového poranění od zdrojové osoby HIV-pozitivní [14].
Provedení
Počet AR léčiv současně nasazených v rámci PEP není explicitně stanoven. Některé zdroje, zejména u rizikovějších poranění, se spíše kloní k trojkombinaci AR léčiv.
Hraniční situace je možné řešit podáním dvojkombinačních režimů.
Za preferovanou kombinaci PEP z hlediska účinnosti, bezpečnosti a tolerance se v současné době považuje:
fixní kombinace dvou léčiv v jedné tabletě TDF/FTC 1× denně + RAL 400 mg 2× denně
(TDF/FTC je aktivní i proti HBV, nelze však použít při renální insuficienci).
Alternativní režimy PEP jsou tvořeny dvojicí léčiv z levého sloupce a jedním léčivem z pravého sloupce [14]:
|
tenofovir + emtricitabin (TDF + FTC) |
raltegravir (RAL) |
|
tenofovir + lamivudin (TDF + 3TC) |
atazanavir/ r (ATV/r) |
|
zidovudin/ lamivudin (AZT/3TC) |
darunavir/ r (DRV/r) |
|
zidovudin + lamivudin (AZT + 3TC) |
lopinavir/ r (LPV/r) |
|
zidovudin + emtricitabin (AZT + FTC) |
etravirin (ETV) nebo rilpivirin (RPV)
|
|
elvitegravir/ cobicistat/ emtricitabin/ tenofovir (EVG/cobi/FTC/TDF)
|
Alternativní režim lze volit s ohledem na nežádoucí účinky léků, odlišné AR léky, než užívá zdrojová osoba atd.
Zahájení PEP: PEP je nutno zahájit co nejdříve od poranění, ideálně do 24-36 hodin [16], v individuálních případech nejdéle do 72 hodin [17,18].
Trvání PEP: 28 dnů.
Sledování a poradenství
K opatřením při expozici infekci HIV nebo podezření na ni je:
- testování zdrojové osoby na HIV (předběžně možno i rychlotestem), HBV, HCV, popř. syfilis (co nejdříve, pokud lze)
- případné přehodnocení expertem (do 2-3 dnů)
- poučení o reálném riziku, příznacích primoinfekce, potřebě sexuální abstinence a ochranných opatřeních sexuálních partnerů a členů domácnosti dokud není jednoznačně potvrzeno ani za 6 měsíců testem ELISA, že nedošlo k sérokonverzi
- odeslat hlášení AIDS centru Na Bulovce.
Doporučený harmonogram laboratorních kontrol při PEP uvádí tabulka 4.
Pokud jsou použity diagnostické testy IV. generace, které jsou schopny detekovat kombinaci antigen/protilátka, lze testování ukončit již po 4 měsících od expozice [16,19].
9.2. Koitální expozice
Indikace
PEP indikována:
- u análního nebo vaginálního styku s osobou HIV pozitivní nebo podezřelou z infekce
- u receptivního orálního styku s ejakulací s osobou HIV pozitivní.
Nechráněný sexuální styk s HIV pozitivní osobou, která má dlouhodobě počet kopií RNA HIV-1 pod hladinou detekovatelnosti, není již považován za indikaci k zahájení PEP [15].
Toto stanovisko lze akceptovat, pokud si HIV-negativní sexuální partner PEP nepřeje a nejde o znásilnění.
Provedení
Provedení PEP se zásadně neliší od PEP u poranění, ale je nadstandardním postupem, který hradí klient [7]. Hraniční situace možno řešit podáním dvojkombinace antiretrovirotik.
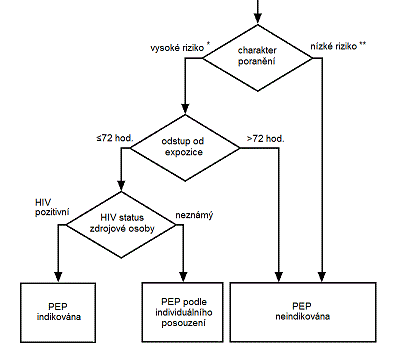
Obr. 1. Algoritmus pro zhodnocení rizika a indikace PEP (volně podle [16])
* Poranění s vysokým rizikem, je-li zdrojová osoba HIV-pozitivní:
perkutánní poranění, expozice neintaktní kůže, expozice vaginální, rektální, expozice očí, úst a jiných sliznic krví, spermatem, vaginálním či rektálním sekretem, mateřským mlékem nebo jinou tělesnou tekutinou viditelně kontaminovanou krví HIV-pozitivní zdrojové osoby.
** Poranění s nízkým rizikem bez ohledu na HIV status zdrojové osoby:
perkutánní kontakt, neintaktní kůže, vagína, rektum, oči, ústa a jiné sliznice exponované moči, nosnímu sekretu, slinám, potu nebo slzám (pokud nejsou viditelně kontaminovány krví) zdrojové osoby.
Zkratky
| Zkratka | Význam |
| ABC | abacavir |
| AFP | alfa-1-fetoprotein |
| AIDS | acquired immunodeficiency syndrome, syndrom získané imunodeficience |
| ALP | alkalická fosfatasa |
| ALT | alaninaminotransferasa |
| AMS | amylasa |
| AR | antiretrovirový |
| ART | antiretrovirová terapie |
| AST | aspartátaminotransferasa |
| ATV | atazanavir |
| B2M | beta-2-mikroglobulin |
| CEA | karcinoembryonální antigen |
| CK | kreatinfosfokinasa |
| CKD-EPI | Chronic Kidney Disease Epidemiology Collaboration formula |
| CNS | centrální nervový systém |
| cobi | cobicistat |
| CrCl | kreatininová clearance |
| CRP | C reaktivní protein |
| DAA | Directly Acting Antivirals |
| ddI | didanosin |
| DRESS | Drug Rash with Eosinophilia and Systemic Symptoms |
| DRV | darunavir |
| DTG | dolutegravir |
| d4T | stavudin |
| EFV | efavirenz |
| eGFR | estimated glomerular filtration rate, odhadovaná hodnota glomerulární filtrace |
| EI | inhibitor vstupu |
| ETV | etravirin |
| EVG | elvitegravir |
| EVG/c | elvitegravir „boostovaný“ cobicistatem |
| EVG/cobi | elvitegravir „boostovaný“ cobicistatem |
| FPV | fosamprenavir |
| FTC | emtricitabin |
| GGT | gama-glutamyltransferasa |
| HBV | virus hepatitidy B |
| HCC | hepatocelulární karcinom |
| HCD | horní cesty dýchací |
| HCV | virus hepatitidy C |
| HD | hemodialýza |
| HIV | human immunodeficiency virus, lidský virus imunodeficience |
| RNA HIV-1 | počet kopií RNA HIV-1, plazmatická virémie, virová nálož |
| HSR | hypersenzitivní reakce |
| InSTI | inhibitor integrasy |
| IRIS | immune restore inflammatory syndrome, syndrom imunitní obnovy |
| KI | kontraindikace |
| KO+dif | krevní obraz a diferenciál leukocytů |
| LDH | laktátdehydrogenasa |
| LPV/r | lopinavir/ritonavir |
| MDRD | modification of diet in renal disease |
| MVC | maraviroc |
| NFV | nelfinavir |
| NNRTI | nenukleosidový inhibitor reverzní transkriptasy |
| NRTI | nukleosidový inhibitor reverzní transkriptasy |
| NtRTI | nukleotidový inhibitor reverzní transkriptasy |
| NVP | nevirapin |
| PCR | polymerázová řetězová reakce |
| PEP | postexpoziční profylaxe |
| PI | inhibitor prote(in)asy |
| PI/r | inhibitor prote(in)asy „boostovaný“ ritonavirem |
| PPI | inhibitory protonové pumpy, proton pump inhibitor |
| PSA | prostatický specifický antigen |
| PTH | parathormon |
| RAL | raltegravir |
| RNA | ribonukleová kyselina |
| RPR | rychlý plazmatický reagin (netreponemový test na syfilis) |
| RPV | rilpivirin |
| RTV | ritonavir |
| SQV | saquinavir |
| TDF | tenofovir |
| TPHA | Treponema pallidum hemaglutinační test (treponemový test na syfilis) |
| TPV | tipranavir |
| T-20 | enfuvirtid |
| VHA | virová hepatitida A |
| VHB | virová hepatitida B |
| VHC | virová hepatitida C |
| VHE | virová hepatitida E |
| WHO | World Health Organization, Světová zdravotnická organizace |
| ZDV | zidovudin |
| 3TC | lamivudin |
Literatura
- Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. April 8, 2015. Developed by the DHHS Panel on Antiretroviral Guidelines for Adults and Adolescents – A Working Group of the Office of AIDS Research Advisory Council (OARAC). Available from: https://aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-treatment-guidelines/0.
- Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection. World Health Organization Publication 2013. Available from: http://www.who.int/hiv/pub/guidelines/arv2013/.
- Günthard HF, Aberg JA, Eron JJ, et al. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA. 2014;312:410-425.
- Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV-1 infection with early antiviral therapy. N Engl J Med. 2011;365:493-505.
- Cohen J. HIV/AIDS research. Tissue says blood is misleading, confusing HIV cure efforts. Science. 2011;334:1614.
- Hoffmann C. Overview of Antiretroviral Agents. In: Hoffmann C, Rockstroh JK. HIV 2012/2013. Hamburg: Medizin Fokus Verlag; 2012. 60-110.
- Rozsypal H, Staňková M, Sedláček D, Snopková S, Kapla J, Aster V, Machala L, Jilich D, Dlouhý P, Kolčáková J, Zjevíková A, Jerhotová J, Olbrechtová L Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV. Vydán: listopad 2012. Verze 1. Available from: https://infektologie.cz/DoporART12.htm.
- Jilich D, Machala L, Rozsypal H, Aster V, Staňková M. Návrh doporučeného postupu očkování u dospělých osob infikovaných virem HIV-1. Klin mikrobiol inf lék. 2008;14(2):59-64. Available from: http://kmil.trios.cz/kmil08023c.htm.
- Lundgren JD, Babiker AG, Gordin F, et al. Initiation of Antiretroviral Therapy in Early Asymptomatic HIV Infection. The INSIGHT START Study Group. N Engl J Med. 2015;373:795-807.
- Guidelines for Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents. October 28, 2014. Recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV medicine Association of the Infectious Diseases Society of America. Available from: https://aidsinfo.nih.gov/guidelines/html/4/adult-and-adolescent-oi-prevention-and-treatment-guidelines/.
- EACS Guidelines. Version 7.1 - November 2014. Available from: http://www.europeanaidsclinicalsociety.org/.
- Hicks CB, Grant P: Agents Used in Antiretroviral Therapy. In: Eron JJ, Kuritykes DR, Squires KE. InPractice HIV. Last Reviewed: 9/23/2015. Jointly Provided by USF Health and Clinical Care Options, LLC. Available from: http://www.inpractice.com/Textbooks/HIV/Antiretroviral_Therapy/ch10_pt1_Overview.aspx.
- Ford N, Meinties G, Pozniak A, Bygrave H, Hill A, Peter T, Davies MA et al. The future role of CD4 cell count for monitoring antiretroviral therapy. Lancet Infect Dis. 2015;15(2):241-247.
- Guideline Summary: Updated U.S.Public Health Service Guidelines for the Management of Occupational Exposures to HIV and Recommendations for Postexposure Prophylaxis. August 1, 2013. AETC Resource Center. Available from: http://aidsetc.org/resource/guideline-summary-updated-us-public-health-service-guidelines-management-occupational.
- EACS Guidelines. Version 8.0 – October 2015. Available from: http://www.eacsociety.org/files/2015_eacsguidelines_8.0-english_revised-20151104.pdf.
- Hurt CB: Management of Occupational and Nonoccupational HIV Exposure. In: Eron JJ., Kuritzkes DR., Squires KE. inPractice HIV. Last Reviewed: 4/13/2015. Available from: http://www.inpractice.com/Textbooks/HIV/Epidemiology_Testing_and_Prevention/ch5_HIV_Exposure/.
- Kuhar DT, Henderson DK, Struble KA, Heneine W, Thomas V, Cheever LW, Gomaa A, Panlilio AL; US Public Health Service Working Group.Infect Control. Updated US Public Health Service guidelines for the management of occupational exposures to human immunodeficiency virus and recommendations for postexposure prophylaxis. Hosp Epidemiol. 2013;34(9):875-92.
- Clinical guidelines across the continuum of care: HIV diagnosis and ART drugs for HIV prevention. World Health Organisation. 30 June 2013. Supplement to Post-exposure prophylaxis for HIV. December 2014. Available from: http://www.who.int/hiv/pub/guidelines/arv2013/December2014-ARVsupplement-chap5.pdf (ve formátu .pdf).
- Günthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, Benson CA, Burger DM, Cahn P, Gallant JE, Glesby MJ, Reiss P, Saag MS, Thomas DL, Jacobsen DM, Volberding PA; InternationalAntiviralSociety-USA Panel. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA. 2014; 312(4):410-25.
- Panel on Treatment of HIV-Infected Pregnant Women and Prevention of Perinatal Transmission. Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV Transmission in the United States. On-line: http://aidsinfo.nih.gov/contentfiles/lvguidelines/PerinatalGL.pdf (ve formátu .pdf). [vid. 18. 10. 2015]
- Williams PL, Crain MJ, Yildirim C, et al. Congenital anomalies and in utero antiretroviral exposure in human immunodeficiency virus-exposed uninfected infants. JAMA Pediatr. 2015;169(1):48-55. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25383770.
- Antiretroviral Pregnancy Registry Steering Committee. Antiretroviral Pregnancy Registry international interim report for 1 Jan 1989 - 31 July 2014. Wilmington, NC: Registry Coordinating Center. 2014. Available at http://www.APRegistry.com.
- Husa P, Šperl J, Urbánek P, Plíšek S, Kümpel P, Rožnovský L. Doporučený postup diagnostiky a léčby chronické hepatitidy B. Klin Mikrobiol Infekč Lék. 2014;20(4):121-32. Available from: https://infektologie.cz/DoporVHB14.htm/.
- Urbánek P, Husa P, Šperl J, Fraňková S, Plíšek S, Rožnovský L, Kümpel P. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Klin mikrobiol inf lék. 2015;21(3):83-98.
- EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol (2015). Available from: http://dx.doi.org/10.1016/ j.jhep.2015.03.025.
Tabelární příloha
Tabulka 1. Laboratorní testy a pomocná rutinní vyšetření
| Vyšetření |
Frekvence |
Podmínka, poznámka |
| krevní obraz a diferenciál |
1×/ 3-6 měsíců* |
|
| základní biochemické vyšetření séra (plazmy): natrium, kalium, chloridy, urea, kreatinin, CKD-EPI (nebo MDRD), bilirubin, ALT, AST, GGT, ALP, LDH, laktát, amylasa, CRP, glykémie, frakce krevních lipidů, B2M |
1×/ 3-6 měsíců* |
|
| moč chemicky + sediment |
1×/ 3-6 měsíců* |
|
| cystatin C |
vstupně a výběrově |
při předpokládané preexistující nefropatii (např. hypertenze, diabetes mellitus, věk >50 let) nebo při léčbě nefrotoxickými léky |
| CK |
1×/ 3-6 měsíců* |
zejména při léčbě statiny |
| Ca++, PO4, vitamin D, PTH |
1×/ rok |
při dlouhodobém užívání ART, při léčbě nefrotoxickými léky, při rizikových faktorech osteoporózy*** |
| PSA |
1×/ 6 měsíců |
muži >45 r. |
| imunologické vyšetření absolutního počtu CD4+ lymfocytů |
1×/ 3-6 měsíců* |
|
| počet kopií RNA HIV-1 v plazmě (plazmatická virémie, virová nálož) metodou PCR |
1×/ 3-6 měsíců* |
zamrazit k případnému vyšetření rezistence |
| test rezistence HIV |
vstupně a výběrově |
|
| sérologie VHA, VHB, VHC, event. VHE |
vstupně a výběrově** |
|
| a-fetoprotein (a-FP) |
1×/ rok |
při cirhóze |
| sérologie syfilidy – screening: RPR, TPHA |
vstupně a výběrově** |
|
| sérologie toxoplasmózy |
1×/ rok |
vstupně u všech, dále u negativních |
| sérologie cytomegaloviru (CMV) |
výběrově |
CD4+ <100/μl |
| onkomarkery (AFP, CEA, Ca 15-3, Ca 19-9, Ca 72-4, Ca 125, stolice na okultní krvácení, screening lymfoproliferativních onemocnění atd.) |
výběrově |
zejména při hlubokém imunodeficitu, chronické VHC a věku &mt;50 let |
| protilátky ke kontrole vakcinace |
výběrově** |
|
| haplotyp HLA B*57:01 |
vstupně |
|
| tropismus R5 |
výběrově** |
pokud je plánována léčba CCR5 antagonisty |
| stolice na okultní krvácení |
1×/ 2 roky |
>50 r. |
| elektrokardiogram (EKG) |
vstupně a výběrově** |
|
| skiagram plic |
vstupně a výběrově** |
dle uvážení lze opakovaná vyšetření vynechat |
| ultrazvukové vyšetření dutiny břišní a retroperitonea |
výběrově** |
u hepatopatie |
* delší interval je přípustný u pacientů léčených ART, kteří v posledních 2 letech udržují konstantně hlubokou virovou supresi pod hladinou detekovatelnosti a nemají žádné signifikantní známky sekundárních nežádoucích jevů spojených s užíváním ART
** výběrová a další vyšetření a jejich frekvenci indikuje ošetřující lékař na základě klinického či laboratorního nálezu nebo možných klinických či epidemiologických souvislostí
*** postmenopauzální ženy, astenický habitus, hypogonadismus, užívání steroidů, zlomenina krčku femuru či snadná zlomenina v anamnéze, kouření, konzumace alkoholu
Tabulka 2. Konziliární vyšetření
| Vyšetření |
Frekvence |
Podmínka, poznámka |
| gynekologické (+ onkologická cytologie) |
1×/ rok |
|
| mamografie |
1×/ 2 roky |
ženy >45 r. |
| venerologické |
výběrově* |
|
| stomatologické |
1×/ rok |
|
| oftalmologické (oční pozadí) |
1×/ rok |
CD4+ <100/μl |
| psychiatrické a psychologické |
výběrově* |
|
| kardiologické |
výběrově* |
|
| nefrologické |
výběrově* |
|
* výběrová a další vyšetření a jejich frekvenci indikuje ošetřující lékař na základě klinického či laboratorního nálezu nebo možných klinických či epidemiologických souvislostí
Tabulka 3. Klinické situace ovlivňující výběr AR režimu
| Faktory dané pacientem nebo AR režimem |
Klinická situace |
Doporučení |
Poznámka |
| výchozí faktory |
CD4+ lymfocyty <200/μl |
nedoporučeny režimy:
- s RPV
- DRV/r + RAL
|
vyšší míra virologického selhání při nižším počtu CD4+ lymfocytů před zahájením léčby
|
| RNA HIV-1 >100 000 kopií/ml |
nedoporučeny režimy:
- s RPV
- DRV/r + RAL |
vyšší míra virologického selhání při nižším počtu CD4+ lymfocytů před zahájením léčby |
| HLA B*57:01 pozitivní |
nedoporučeny režimy obsahující ABC |
vysoká pravděpodobnost hypersensitivní reakce a potenciálně fatální reakce při pozitivitě alely HLA B*57:01 |
| nezbytnost zahájení léčby před provedením testu rezistence |
nedoporučeny režimy s NNRTI |
vpřítomnost rezistentní mutace k NNRTI je pravděpodobnější, než k PI nebo InSTI |
| typ AR režimu |
požadavek 1 tableta 1× denně |
možnosti:
- DTG/ABC/3TC
- EFV/TDF/FTC
- EVG/c/TDF/FTC
- EVG/c/TAF/FTC
- RPV/TDF/FTC (jestliže počet kopií RNA HIV-1 <100 000/ml a počet CD4+ lymfocytů >200/μl)
|
fixní kombinace více léčiv v jedné tabletě
|
| efekt jídla |
režimy, které je třeba užívat s jídlem:
- režim s ATV/r nebo ATV/c
- režim s DRV/r nebo DRV/c
- EVG/c/TDF/FTC
- RPV/TDF/FTC
|
jídlo zlepšuje absorpci uvedených režimů
|
režimy, které je třeba užívat nalačno:
- režimy s EFV
|
jídlo zvyšuje absorpci EFV a může tím zvýšit vedlejší nežádoucí účinky na CNS
|
| koinfekce |
infekce HBV |
preferovat TDF/FTC nebo TDF + 3TC,
pokud je TDF kontraindikován:
- FTC nebo 3TC s entecavirem nebo jiným aktivním léčivem proti HBV
|
fixní kombinace více léčiv v jedné tabletě
|
|
infekce HCV |
léčba koinfikovaných HCV/HIV je stejná, jako HIV-negativních
|
léčbu je třeba zahájit co nejdříve, protože hrozí rychlá progrese nemoci do jaterní cirhózy nebo HCC
|
|
tuberkulóza |
pokud je podáván rifampicin:
- režimy s EFV mají nejméně lékových interakcí
- u režimů s RAL je třeba zvýšit dávku RAL na 800 mg 2× denně
- DTG 50 mg 2× denně pouze v případě, kdy nejsou přítomny rezistentní mutace k InSTI
|
rifampicin
- je silný induktor enzymů CYP3A4 a UGT1A1, způsobujících signifikantní snížení koncentrace PI, InSTI a RPV
- má méně signifikantní efekt na koncentraci EFV než na jiné NNRTI, PI a InSTI
|
|
pokud je podáván režim s PI, je třeba rifampicin nahradit rifabutinem
|
rifabutin
- je slabší induktor a má dobrý efekt, pokud jsou užívány ART režimy jiné, než s EFV
|
| jiné stavy |
chronické onemocnění ledvin (GF <60 ml/min) |
vyhnout se TDF |
TDF je spojen s renální tubulopatií
|
nepodávat při GF <70 ml/min:
- EVG/c/TDF/FTC
- ATV/c s TDF
- DRV/c s TDF
|
viz tab. 12 doporučení pro korekci dávky AR léčiv při onemocnění ledvin
|
možnost: ABC/3TC při negativitě HLA B*57:01:
- nepodávat ABC/3TC s EFV nebo ATV/r při RNA HIV-1 >100 000 kopií/ml
- nepodávat ABC/3TC při CrCl <50ml/min, pro 3TC je třeba korekce dávky
|
jiné možnosti:
- DRV/r + RAL (jestliže RNA HIV-1 <100 000 kopií/ml a CD4+ lymfocyty >200/μl)
- LPV/r + 3TC
- LPV/r + RAL
- korekce dávky TDF
|
osteoporóza |
nepodávat
- TDF
podávat
- ABC/3TC, pokud je HLA B*5701 negativní
- ABC/3TC + (EFV nebo ATV/r), pokud je RNA HIV-1 <100 000 kopií/ml
|
TDF je spojen s větším úbytkem minerální kostní denzity, s renální tubulopatií, s úbytkem fosfátů a osteomalácií
|
psychiatrická onemocnění |
vyhnout se
- režimům s EFV
|
EFV může způsobit exacerbaci psychiatrických symptomů a může vést k suicidiu
|
HIV-demence (HAD) |
vyhnout se pokud možno
- režimům s EFV
upřednostnit
- režim s DRV nebo DTG
|
neuropsychiatrický efekt EFV může překrýt symptomy HAD
|
substituční terapie narkotik |
pokud užívá metadon
- vyhnout se režimům s EFV
pokud užívá EFV
- je nezbytné zvýšit dávku metadonu
|
EFV snižuje koncentraci metadonu a může vést k abstinenčním symptomům
|
vysoké kardiovaskulární riziko |
vyhnout se režimům s ABC a LPV/r
|
|
dyslipidemie (hyperlipidemie) |
skupina léčiv a léčiva, která mají potenciál k alteraci krevních lipidů:
- PI/r
- ABC
- EFV
- EVG/c
|
TDF nemá významný potenciál k alteraci lipidového spektra, je proto preferován před ABC
|
* výběrová a další vyšetření a jejich frekvenci indikuje ošetřující lékař na základě klinického či laboratorního nálezu nebo možných klinických či epidemiologických souvislostí
Tabulka 4. Doporučený harmonogram laboratorních kontrol při indikaci PEP
| Laboratorní vyšetření |
před zahájením PEP |
během PEP |
1 měsíc po expozici |
3 měsíce po expozici |
6 měsíců po expozici |
| anti-HIV* |
+ |
|
+ |
+ |
+ |
| KO+dif |
+ |
+ |
|
|
|
| jaterní enzymy |
+ |
+ |
|
|
|
| urea, kreatinin |
+ |
+ |
|
|
|
| syfilis |
+ |
+ |
+ |
|
|
| HBV |
+ |
|
+ |
+ |
|
| HCV |
+ |
|
|
+ |
+ |
| těhotenský test |
+ |
+ |
+ |
|
|
* při dostupnosti diagnostických souprav ELISA IV. generace lze sledování zkrátit na 4 měsíce
Tabulka 5. Použití hypolipidemik u pacientů léčených antiretrovirotiky
| Léková skupina |
Lék |
Dávka |
Vedlejší efekt |
| inhibitory HMG CoA reduktasy (statiny) |
atorvastatin |
10-80 mg 1× denně |
gastrointestinální příznaky, bolesti hlavy, nespavost, rhabdomyolýza, toxická hepatitida |
| fluvastatin |
20-80 mg 1× denně |
| pravastatin |
20-80 mg 1× denně |
| rosuvastatin |
5-40 mg 1× denně |
| selektivní inhibitor absorpce cholesterolu |
ezetimib |
10 mg 1× denně |
gastrointestinální příznaky |
Tabulka 6. Přehled nukleosidových a nukleotidových inhibitorů reverzní transkriptasy
Generický název
Zkratka
Obchodní název |
Dávkování |
Hlavní nežádoucí účinek |
Poznámka |
tenofovir
TDF
Viread | 1× 300 mg/d | nauzea, zvracení, průjem
renální insuficience, pokles kostní denzity
KI: adefovir | užívat s jídly
kontroly renálních funkcí |
abacavir
ABV
Ziagen | 2× 300mg/d nebo 1× 600 mg/d | hypersenzitivní reakce (5 %) | nebezpečí hypersenzitivní reakce, lze anticipovat po průkazu haplotypu HLA-B*57:01, opětovné zahájení léčby může být život ohrožující |
zidovudin (azidothymidin)
ZDV (AZT)
Retrovir | 2× 250-300 mg/d | anémie, méně neutropenie
nauzea
xerostomie, pigmentace nehtů
myopatie
KI: ribavirin | kontroly krevního obrazu |
emtricitabin
FTC
Emtriva | 1× 200 mg/d | minimálně toxický
průjem, nauzea
cefalgie
hyperpigmentace dlaní, plosek a nehtů | |
lamivudin
3TC
Epivir | 2× 150 mg/d nebo 1× 300 mg/d | minimálně toxický, výjimečně cefalgie, únava | |
didanosin
ddI
Videx EC | <60 kg: 1×250 mg/d,
>60 kg: 1×400 mg/d | pankreatitida (6 %)
periferní neuropatie
průjem, nauzea, cefalgie
KI: ribavirin, d4T, TDF, allopurinol | užívat nalačno |
stavudin
d4T
Zerit | <60 kg: 1× 30 mg/d,
>60 kg: 1× 40 mg/d | periferní neuropatie
pankreatitida
nauzea, zvracení, průjem, elevace aminotransferas | užívat s jídly
vyšší riziko lipoatrofie |
Tabulka 7. Přehled nenukleosidových inhibitorů reverzní transkriptasy
Generický název
Zkratka
Obchodní název |
Dávkování |
Hlavní nežádoucí účinek |
Poznámka |
nevirapin
NVP
Viramune | 1× 200 mg/d 14 dní, dále 2× 200 mg/d | exantém (37 %)
hepatitida, jaterní selhání – častěji u žen, vyššího počtu CD4+ a chronických hepatopatiích
KI: rifampicin, nevirapin, třezalka | relativní kontraindikace u žen s CD4+ >250/ml a u mužů s CD4+ >400/ml
neúčinný u subtypu O a HIV typu 2 |
efavirenz
EFV
Stocrin, (Sustiva) | 1× 600 mg/d (večer) | vertigo, nespavost, „živé“ sny, zmatenost
exantém
KI: vorikonazol, triazolam, p.o. midazolam, boceprevir, simeprevir, třezalka | užívat nalačno a před spaním
kontraindikován v graviditě
neúčinný u subtypu O a HIV typu 2 |
etravirin
ETV
Intelence | 2× 200 mg/d | exantém
hypersenzitivní syndrom
DRESS syndrom
KI: carbamazepin, rifampicin, fenobarbital, fenytoin, simeprevir, třezalka
| užívat s jídly, léčba infekce HIV-2 se nedoporučuje |
rilpivirin
RPV
Edurant | 1× 25 mg/d | exantém
deprese, nespavost, bolest hlavy
hepatotoxicita
prodloužení intervalu QTc na EKG
KI: PPI, carbamazepin, fenobarbital, fenytoin, rifabutin, rifampicin, třezalka
| užívat s jídly, neúčinný u subtypu O a HIV-2 |
Tabulka 8. Přehled inhibitorů proteinasy
Generický název
Zkratka
Obchodní název |
Dávkování
(s RTV = potencování malou dávkou RTV) |
Hlavní nežádoucí účinek |
Poznámka |
lopinavir/ritonavir
LPV/r
Kaletra | 2× 400/100 mg/d (2× 2 tabl/d)
s EFV či NVP: 2× 600/150 mg/d (2× 3 tabl/d) | průjem
hyperlipidémie
elevace aminotransferas
KI: warfarin, amiodaron, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka | |
darunavir
DRV
Prezista | s RTV: 1× 800/100 mg/d (u naivních pacientů),
2× 600/100 mg/d (u předléčených pacientů) | exantém, průjem, nauzea
KI: warfarin, amiodaron, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka | užívat s jídly, odlišný profil rezistence |
atazanavir
ATV
Reyataz | 1× 400 mg/d,
s RTV: 1× 300/100 mg/d | nepřímá hyperbilirubínémie až viditelný ikterus
prodloužení PR na EKG
KI: warfarin, amiodaron, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka
| užívat s jídly
nepodávat současně s H2 inhibitory a inhibitory protonové pumpy |
fosamprenavir
FPV
Telzir | 2× 1400 mg/d,
s RTV: 2× 700/100 mg/d nebo 1× 1400/200mg/d | exantém
průjmy
KI: warfarin, amiodaron, flekainid, propafenon, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka | |
tipranavir
TPV
Aptivus | s RTV: 2× 500/200 mg/d | nauzea, zvracení, průjem
exantém (více u žen)
hepatitida
hyperlipémie
KI: warfarin, amiodaron, flekainid, propafenon, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka | užívat s jídly
pozor u alergie na sulfonamidy |
saquinavir
SQV
Invirase | 3× 600-1200 mg/d,
s RTV: 2× 1000/100 mg/d | nauzea, bolesti břicha, plynatost, bolesti břicha, cefalgie
KI: warfarin, amiodaron, flekainid, propafenon, rifampicin, midazolam, triazolam, lovastatin, simvastatin, třezalka | užívat s jídly |
Pozn.: Nelfinavir a indinavir již nejsou doporučovány k léčbě infekce HIV
Tabulka 9. Přehled inhibitorů integrázy
Generický název
Zkratka
Obchodní název |
Dávkování |
Hlavní nežádoucí účinek |
Poznámka |
raltegravir
RLV
Isentress | 2× 400 mg/d
s rifampicinem 2× 800 mg/d
| hypersenzitivní reakce
průjem, nauzea
bolest hlavy, horečka
svalová slabost, elevace CK | Al-Mg antacida nepodávat současně či během 2 hod, lze podávat CaCO3 antacida, nejsou interakce CYP3A4 |
dolutegravir
DTG
Tivicay | 1× 50 mg/d,
u dříve léčených InSTI s prokázanou či suspektní rezistencí k InSTI 2× 50 mg/d | hypersenzitivní reakce
hepatopatie
nespavost, bolesti hlavy
KI: carbamazepin, fenobarbital, fenytoin, ETV, třezalka, zvýšení plazmatické koncentrace metforminu
| 2 hod před nebo 6 hod po užití
léčiv obsahujících polyvalentní kationty, antacida, laxativa, Fe, Ca, Mg, Al, Zn, minerály, sucralfát, multivitaminy, doplňky stravy
|
elvitegravir
EVG
Vitekta | s cobi: 1× 150 mg/d | nauzea, průjem
nefropatie
KI: rifabutin, rifampicin, triazolam, midazolam, metylprednisolon, ergotamin, prednisolon, triamcinolon, boveprevir, simeprevir, lovastatin, simvastatin, sildenafil, jiná AR léčiva, třezalka
| 2 hod před nebo 6 hod po užití
léčiv obsahujících polyvalentní kationty, antacida, laxativa, Fe, Ca, Mg, Al, Zn, minerály, sucralfát, multivitaminy, doplňky stravy
|
Tabulka 10. Přehled inhibitorů vstupu - inhibitor fúze a antagonista CCR5
Generický název
Zkratka
Obchodní název |
Dávkování |
Hlavní nežádoucí účinek |
Poznámka |
maraviroc
MVC
Celsentri, (Selzentry) | 2× 300 mg/d,
s inhibitory CYP3A4: 2× 150 mg/d,
s induktory CYP3A4: 2× 600 mg/d *) | bolesti břicha
kašel
slabost až ortostatická hypotenze
KI: rifampicin, telaprevir, třezalka
| vyžaduje vyšetření tropismu ke koreceptoru CCR5 (tropotypu C5) |
enfuvirtid
T-20
Fuzeon | 2× 90 mg/1ml/d s.c. | kožní iritace v místě vpichu – bolest a zarudnutí po aplikaci
periferní neuropatie (2 %)
záněty horních dýchacích cest až pneumonie | náročná příprava (ředění) a vlastní aplikace |
Pozn.: Přehled léčiv potenciálně ovlivňujících hladinu maravirocu je uveden v tabulce 11
Tabulka 11. Interakce na úrovni jaterních cytochromových enzymů
| Skupina |
Zástupci |
Výsledek |
| Inhibitory CYP3A4 |
inhibitory proteinasy
(kromě tipranaviru a fosamprenaviru)
ketokonazol, itrakonazol
clarithromycin
telithromycin
| zvýšené hladiny léků, které jsou substráty |
| Induktory CYP3A4 | efavirenz
rifampicin
| snížené hladiny léků, které jsou substráty |
Tabulka 12. Fixní kombinace více léčiv v jedné tabletě
| Složení |
Obchodní název |
Dávkování |
ABV/3TC | Kivexa, (Epzicom) | 1× (600/300) mg/d |
FTC/TDF | Truvada | 1× (200/300) mg/d |
ZDV/3TC | Combivir | 2× (300/150) mg/d |
ZDV/3TC/ABV | Trizivir | 2× (300/150/300) mg/d |
LPV/r | Kaletra | 2× (400/100) mg/d nebo
1× (800/200) mg/d |
DRV/c | Rezolsta, Prezcobix | 1× (800/150) mg/d |
ATV/c | Evotaz | 1× (300/150) mg/d |
EFV/FTC/TDF | Atripla | 1× (600/200/300) mg/d |
RPV/TDF/FTC | Eviplera, Complera | 1× (25/300/200) mg/d |
EVG/cobi/TDF/FTC | Stribild | 1× (150/150/300/200) mg/d |
EVG/cobi/TAF/FTC | Genvoya | 1× (150/150/10/200) mg/d |
DTG/3TC/ABC | Triumeq | 1× (50/300/600) mg/d |
Tabulka 13. Úprava dávkování antiretrovirotik u nedostatečnosti ledvin
| Léčivo |
eGFR (mL/min) |
HD |
| ≥50 |
30-49 |
10-29 |
<10 |
| tenofovir, TDF |
300 mg/ 24 hod |
300 mg/ 48 hod |
nedoporučuje se, není-li alternativa: 300 mg/ 72-96 hod |
nedoporučuje se, není-li alternativa: 300 mg/ 7 dní |
300 mg/ 7 dní po HD |
| abacavir, ABV |
300 mg/ 12 hod |
| zidovudin, ZDV |
300 mg/ 12 hod |
100 mg/ 8 hod |
| emtricitabin, FTC |
200 mg/ 24 hod |
200 mg/ 48 hod |
200 mg/ 72 hod |
200 mg/ 96 hod |
200 mg/ 96 hod |
| tenofovir/ emtricitabin, TDF/FTC |
300/200 mg/ 24 hod |
300/200 mg/ 48 hod |
nedoporučeno |
| lamivudin, 3TC |
300 mg/ 24 hod |
150 mg/ 24 hod |
100 mg/ 24 hod |
25-50 mg/ 24 hod |
25-50 mg/ 24 hod po HD |
| didanosin, ddI |
≥60 kg: 400 mg/ 24 hod
<60 kg: 250 mg/ 24 hod |
≥60 kg: 200 mg/ 24 hod
<60 kg: 125 mg/ 24 hod |
≥60 kg: 150 mg/ 24 hod
<60 kg: 100 mg/ 24 hod |
>≥60 kg: 100 mg/ 24 hod
<60 kg: 75 mg/ 24 hod |
| stavudin, d4T |
>60 kg: 40 mg/ 12 hod
<60 kg: 30 mg/ 12 hod |
>60 kg: 20 mg/ 12 hod
<60 kg: 15 mg/ 12 hod |
>60 kg: 20 mg/ 24 hod
<60 kg: 15 mg/ 24 hod |
>60 kg: 20 mg/ 24 hod
<60 kg: 15 mg/ 24 hod |
>60 kg: 20 mg/ 24 hod po HD
<60 kg: 15 mg/ 24 hod po HD |
| etravirin, ETV |
200 mg/ 12 hod |
| nevirapin, NVP |
200 mg/ 12 hod |
| efavirenz, EFV |
600 mg/ 24 hod |
| rilpivirin, RPV |
25 mg/ 24 hod |
| RPV/TDF/FTC |
nedoporučeno při CrCl <50 ml/min, preferovat individuální léčiva a korigovat dávku TDF a FTC |
| lopinavir/ ritonavir, LPV/r |
400/100 mg/ 12 hod |
| darunavir/ ritonavir, DRV/r |
800/100 mg/ 24 hod |
| atazanavir/ ritonavir, ATV/r |
nedoporučuje se, není-li alternativa: 300/100 mg/ 24 hod |
| saquinavir/ ritonavir, SQV/r |
1000/100 mg/ 12 hod |
| fosamprenavir/ ritonavir, FPV/r |
700/100 mg/ 12 hod, resp. 500/200 mg/ 12 hod |
| dolutegravir, DTG |
50 mg/ 24 hod nebo 50 mg/ 12 hod
|
| EVG/cobi/TDF/FTC |
KI: CrCl <70 ml/min
ukončit podávání EVG/cobi/TDF/FTC jestliže během ART klesne CrCl <50 ml/min
|
| raltegravir, RLV |
400 mg/ 12 hod |
400 mg/ 12 hod po HD |
| maraviroc, MVC |
bez inhibitorů CYP3A4: 300 mg/ 12 hod
s inhibitory CYP3A4: při eGFR <80 ml/min redukce dávky |
| enfuvirtid, T20 |
90 mg/ 12 hod s.c. |
|


