Infekce endoprotéz: doporučení antibiotické léčby
Česká společnost pro ortopedii a traumatologii (ČSOT)
a Společnost infekčního lékařství (SIL) ČLS JEP
Autoři:
| MUDr. David Musil, Ph.D. | Ortopedické oddělení, Nemocnice České Budějovice, a.s. Zdravotně sociální fakulta, Jihočeská univerzita v Českých Budějovicích |
| MUDr. Magda Balejová | Laboratoř klinické mikrobiologie, Nemocnice České Budějovice, a.s. |
| MUDr. Magdalena Horníková | Laboratoř klinické mikrobiologie, Nemocnice České Budějovice, a.s. |
| MUDr. Aleš Chrdle | Infekční oddělení, Nemocnice České Budějovice, a.s. |
| MUDr. Naďa Mallátová | Laboratoř klinické mikrobiologie, Nemocnice České Budějovice, a.s. |
| MUDr. Ota Nyč, Ph.D. | Ústav lékařské mikrobiologie 2. LF UK a FN Motol, Praha |
| MUDr. Václav Chmelík | Infekční oddělení, Nemocnice České Budějovice, a.s. |
| Prof. MUDr. Jiří Gallo, Ph.D. | Ortopedická klinika LF UP a FN Olomouc |
| Prof. MUDr. David Jahoda, CSc. | 1. ortopedická klinika 1. LF UK a FN Motol, Praha |
| Doc. MUDr. Jiří Stehlík, CSc. | Ortopedické oddělení, Nemocnice České Budějovice, a.s. Zdravotně sociální fakulta, Jihočeská univerzita v Českých Budějovicích |
Schváleno
- výbory ČSOT, SIL ČLS JEP v březnu 2017
Obsah
Abstrakt
Úvod
Materiál a metoda
Výsledky
Etiologická agens
Staphylococcus aureus
Koaguláza negativní stafylokoky (CONS)
Streptokoky
Enterokoky
Aerobní a fakultativně anaerobní gram negativní tyčky
Propionibacterium acnes
Ostatní anaerobní bakterie
Polymikrobiální infekce
Ostatní bakterie
Mykobakteria
Kultivačně negativní IKN
Mykotické komplikace TEP
Terapeutické monitorování léků (TDM)
Vankomycin
Gentamicin
Vorikonazol
Biofilm: Rifampicin a ciprofloxacin
Průnik antibiotik do tkání kolem infikovaného protetického materiálu
Nežádoucí účinky
Diskuse
Registrovaná indikace pro léčbu kostí a kloubů (a podání off-label)
Závěr
Důležité poznámky
Tabulky a obrázky
Tab. 1: Infekce totální endoprotézy - antibiotická kurativní léčba
Tab. 2: Doba antibiotické léčby podle typu výkonu
Tab. 3: Infekce totální endoprotézy - chronická supresivní léčba
Tab. 4: Určení dávky vankomycinu – úvodní a udržovací léčba
Tab. 5: Určení dávky vankomycinu u hemodialyzovaných pacientů – úvodní a udržovací léčba
Tab. 6: Určení dávky gentamicinu – úvodní a pokračovací léčba
Obr. 1: Nomogram k stanovení dávky gentamicinu
Tab. 7: Antibiotika - vlastnosti a cena
Literatura
Poděkování
Abstrakt
Cíl práce:
Cílem práce bylo vytvoření regionálního doporučení pro kurativní a supresivní antibiotickou léčbu
infekcí totálních kloubních náhrad.
Materiál:
Podkladem pro vytvoření standardu byla publikovaná zahraniční doporučení pro antibiotickou léčbu
infekcí kloubních náhrad, analýza rezistencí bakteriálních kmenů v Nemocnici České Budějovice, a.s.
a zhodnocení rezistencí kmenů pro Českou republiku publikovaných European Antimicrobial
Resistance Surveillance Network (EARS-Net). V úvahu také byla vzata dostupnost jednotlivých
antibiotik v České republice a preskripční omezení podle Souhrnu údajů o přípravku dle registrace
Státního ústavu pro kontrolu léčiv.
Metody:
Expertní skupina složená z ortopedů, mikrobiologů a infektologů připravila základní antibiotické
doporučení pro volbu vhodného antibiotika/antimykotika dle obvyklé citlivosti, jeho dávky a doby
podávání pro úvodní a následnou (pokračovací) léčbu. Postupně byly zapracovány připomínky
jednotlivých odborností a v případě nejasností zvolen většinový konsensus. V připravené formě byl
materiál zaslán k oponentuře na klinická ortopedická, infektologická a mikrobiologická pracoviště,
jejichž připomínky byly opět zapracovány, a v této podobě byl materiál předán k posouzení
odborným společnostem.
Výsledky:
Výsledkem je předkládané doporučení pro antibiotickou kurativní a supresivní léčbu vhodnou při
léčbě infekcí kloubních náhrad, které bylo schváleno výbory České společnosti pro ortopedii a
traumatologii a Společnosti infekčního lékařství ČLS JEP.
Diskuze:
Kurativní léčba infekce totální kloubní náhrady je primárně chirurgická a musí být doplněna
adekvátní antibiotickou léčbou v iniciální intravenózní formě a následné perorální formě po
dostatečně dlouhou dobu. Vzhledem k širokému spektru patogenů, které mohou způsobit infekci
kloubní náhrady a jejich schopnosti tvořit biofilm na cizorodém materiálu, je správná volba typu
antibiotika, jeho dávky a doby používání zásadní pro úspěch léčby. Takový standard by měl
respektovat regionální dostupnost antibiotik, regionální výskyt rezistence / citlivosti patogenů a
zajistit dosažení dostatečně účinné hladiny v požadované lokalitě včetně protibiofilmové aktivity.
Závěr:
Předkládaná doporučení nejsou jedinou léčebnou možností infekcí totálních náhrad, ale jsou vhodná
pro usnadnění rozhodování v léčbě těchto infekčních komplikací. Definitivní volba antibiotika, jeho
dávky a doby používání musí vycházet z kritického posouzení výsledků mikrobiologických
(kultivačního a molekulárně-genetického) vyšetření a reflektovat klinický stav pacienta. Vzhledem
k tomu, že jde o multioborovou problematiku, považujeme za účelné, že toto doporučení bylo
připomínkováno a schváleno výborem ortopedické i infekční společnosti, a může tak tvořit základ léčby.
Úvod
Infekční komplikace v kloubní aloplastice stále patří mezi nejzávažnější komplikace této jinak mimořádně úspěšné oblasti ortopedické operativy (14). I přes zavádění přísných preventivních opatření není možné infekce totálních kloubních náhrad (TEP) zcela eliminovat a vzhledem k rostoucímu počtu pacientů s implantovanou endoprotézou narůstají počty infekcí TEP jak v absolutních, tak i v relativních číslech. Na absolutním i relativním nárůstu se podílí řada faktorů: indikace implantace TEP se rozšiřuje i na skupiny rizikovějších polymorbidních či imunosuprimovaných pacientů, pacienti, kteří jsou v době implantace v dobrém zdravotním stavu, se dožívají vyššího věku a přežívají s chronickými chorobami, které je oslabují, mnoho let po implantaci. Současně také dochází ke zvýšenému výskytu rezistentních bakteriálních druhů. Cílem práce bylo vytvoření regionálního doporučení antibiotické terapie infekcí totálních kloubních náhrad.
Materiál a metoda
Zatímco práce zaměřené na prevenci a profylaktické podání antibiotik v našem regionu již publikované byly (7, 12, 13), problematika terapeutického podání antibiotik u infekcí TEP dosud nebyla pro stejnou oblast komplexně zpracována. Částečně je možné použít zahraniční doporučení (18, 22, 23, 24, 25, 26, 36, 44), ale tato nezohledňují regionální (ne)dostupnost některých antibiotik v České republice, a především nereflektují odlišný lokální výskyt rezistencí. Antibiotická léčba periprotetických infekcí je oblast, ve které se úzce prolínají tři různé specializace, a tedy tři různé pohledy na problematiku. Z tohoto důvodu jsme vytvořili tým skládající se z ortopedů, mikrobiologů a infektologů a rozhodli jsme se vytvořit vlastní doporučení antibiotické léčby, do kterého budou zapracovány připomínky a požadavky všech zúčastněných specializací. Prvním krokem bylo prostudování zahraničních doporučení, ze kterých byla vyřazena antibiotika, která nejsou v našem regionu dostupná vůbec nebo jen velmi obtížně. Dále byla porovnána rezistence kmenů v naší lokalitě a regionální publikovaná rezistence pro Českou republiku. Následně byla vybrána antibiotika, jejichž aktivita zahrnuje nejčastější původce infekcí kloubních náhrad jako hlavní a alternativní možnost antibiotické léčby s dobrou tkáňovou dostupností, nízkou rezistencí a regionální tradicí. Vždy byla preferována baktericidní antibiotika a byla volena dostatečně vysoká dávka tak, aby bylo možno dosáhnout co nejvyšší koncentrace antibiotika v požadované oblasti. Antibiotické kombinace byly voleny tak, aby pokud možno obsahovaly antibiotikum s předpokládanou protibiofilmovou aktivitou (43), respektive s co nejlepším průnikem do biofilmu. Léčba se zahajuje útočnou intravenózní terapií a dále doporučení obsahuje vždy pokračovací perorální variantu, je-li dostupná. V základních krocích přípravy doporučení byla zvolena elektronická komunikace a zapracovány byly postupně všechny připomínky, následně bylo zorganizováno setkání autorů, při kterém byly navrhované možnosti diskutovány a voleno konsensuální řešení. V této podobě bylo doporučení zasláno na další klinická pracoviště k připomínkovému a oponentnímu řízení a případné podněty byly zapracovány do textu.
S ohledem na rychlý vývoj mikrobiologických diagnostických metod a dosud neustálený konsensus v oblasti diagnostiky IKN se doporučený postup nezabývá diagnostikou infekce kloubních náhrad ani způsoby odběru a vyšetření biologického materiálu, ale i v této problematice, vzhledem k její důležitosti pro volbu vhodného postupu, na vytvoření standardu pracujeme (8,21)
Je třeba si uvědomit, že kurativní léčba periprotetických infekcí je vždy operační, avšak ta musí být doplněna lokální a celkovou léčbou antibiotiky. Ke správné volbě postupu je nutné znát etiologické agens, dobu trvání infekce, celkový stav pacienta, lokální stav měkkých tkání a stav skeletu a fixaci protézy. Na základě těchto informací je možné volit radikální debridement s výměnou mobilních částí, jednodobou výměnu, dvoudobou výměnu, trojdobou výměnu, prostou extrakci protézy, artrodézu, či v krajním případě i amputaci (21). Doporučení obsahuje i dobu podávání antibiotik v jednotlivých fázích léčby s ohledem na zvolený typ implantátů.
Ani ve světové literatuře není doba podávání antibiotik jasně určená. Existuje spíše konsensuální doba podávání a ta je součástí našeho doporučení. Za zásadní je považováno udržení dostatečné plazmatické hladiny antibiotik tak, aby mohla v koncentračním gradientu dobře pronikat do kostních struktur a měkkých tkání kloubu a zároveň byl omezen jejich toxický účinek. Vzhledem k délce antibiotické léčby je doporučený postup doplněn o dávkovací a monitorovací schéma dvou toxických antibiotik s úzkým terapeutickým indexem, vankomycinu a gentamicinu. Podobně se doporučuje monitorovat terapeutické hladiny v případě podávání vorikonazolu (a itrakonazolu). V elektronické formě doporučení obsahuje i výběr nejvýznamnějších interakcí a nežádoucích účinků jednotlivých antibiotik.
Pro případ inoperabilních pacientů nebo tam, kde nelze dosáhnout vyléčení infekce, je součástí doporučení chronická supresivní antibiotická léčba, která nemá za cíl infekci vyléčit, ale zabránit jejímu šíření a pokud možno zajistit nebolestivou funkční kloubní náhradu. Proto jsou použita antibiotika v nižších dávkách s cílem dlouhodobého (někdy i doživotního) podávání (19, 29). Ve finální podobě byl materiál předložen výboru České společnosti pro ortopedii a traumatologii, Společnosti infekčního lékařství ČLS JEP, Společnosti pro lékařskou mikrobiologii ČLS JEP a Subkomisi pro antibiotickou politiku SKAP ČLS JEP s cílem dosáhnout doporučení garantovaného všemi čtyřmi odbornými společnostmi.
Výsledky
Infekce kloubních náhrad (IKN) diagnostikované v době do jednoho až dvou let od provedení operačního výkonu vznikají kontaminací kloubní náhrady přímým kontaktem nebo aerosolem v průběhu operačního výkonu. Další, méně častou možností, ke které může dojít kdykoliv v době přítomnosti implantátu, je infekce hematogenní, kdy se bakterie uchytí na implantátu v průběhu bakteriémie. Bakterie, které se dostanou do kontaktu s povrchem umělé kloubní náhrady, se na tuto přichytí a začnou vytvářet biofilm. Biofilm může být monomikrobiální nebo polymikrobiální. I monobakteriální biofilm je tvořen subpopulacemi s různými fenotypovými i genotypovými vlastnostmi. Tyto subpopulace mohou mít odlišnou makroskopickou morfologii, odlišný antibiogram, některé mohou persistovat i intracelulárně, i když primárně nejde o intracelulární patogeny. Bakterie se v biofilmu chovají jako komunikující společenství s různými funkcemi jednotlivých subpopulací, což způsobuje, že i bakterie běžně považované za nepatogenní, se mohou v biofilmu na cizorodém materiálu chovat jako patogeny. Bakterie jsou v biofilmu navíc chráněny před účinkem antimikrobiálních látek a imunitního systému hostitele a vzhledem k pomalému růstu mívají i sníženou citlivost k antimikrobiálním látkám, což činí tyto infekce obtížně léčitelnými.
Většina infekcí kloubních náhrad je působena grampozitivními koky, z nichž asi 50-60 % tvoří stafylokoky a 10 % enterokoky a streptokoky. Gramnegativní tyčky aerobní a fakultativně anaerobní jsou původci méně než 10 % IKN. V ostatních případech se jedná v nízkém procentu o méně běžná agens. Množství IKN bez prokázané etiologie se v jednotlivých studiích liší podle: použitých metod průkazu agens, hodnocení kultivačních nálezů (pozitivní kultivační nález může být kontaminací), užití antimikrobiálních látek před operačním výkonem, počtu a typů vzorků získaných pro kultivační, případně molekulárně genetická vyšetření.
Staphylococcus aureus a gramnegativní tyčky působí celkem asi 60% časných IKN, tj. vzniklých do 3 měsíců od operačního výkonu. Časný projev infekce je dán vyšší virulencí těchto agens. IKN, vzniklé po třech měsících až do 2 let od operačního výkonu, jsou působeny agens s nižší virulencí, (především koaguláza negativními stafylokoky a enterokoky). Pozdní IKN, vzniklé více než 2 roky po operaci, bývají spíše hematogenního původu a nejčastějším původcem je v těchto případech S. aureus. Riziko vzniku IKN při bakteriémii S. aureus je 30–40 %. Méně často jsou působeny málo virulentními agens, uchycenými na implantát v době operace.
Infekce náhrady kyčelního kloubu je nejčastěji působena koaguláza negativními stafylokoky, méně často S. aureus. Infekce náhrad kolenního kloubu je působena oběma agens v přibližně stejném poměru. Propionibacterium acnes je častěji původcem infekcí náhrady kyčelního kloubu než kolenního, nejčastěji je ale nalézáno u implantátů ramenního kloubu, kde jinak převažují koaguláza negativní stafylokoky. Infekce náhrady loketního kloubu jsou stafylokokové etiologie více než ze tří čtvrtin, působeny S. aureus i koaguláza negativními stafylokoky (2).
Etiologická agens
Staphylococcus aureus
Je hlavní původce IKN, především časných infekcí, ale i infekcí pozdních, hematogenního původu. Je obecně původcem vážných infekcí včetně nozokomiálních, s možnou bakteriémií, která může být zdrojem IKN a která v případě etiologie S. aureus mívá akutní průběh. Pacienti s IKN s etiologií S. aureus mívají ve 30-40 % diabetes mellitus, v 10 – 20 % revmatoidní arthritis a další komorbidity (2). Obtížná léčitelnost těchto infekcí může být způsobena i Small Colony Variants (SCV) S. aureus, které se mohou vytvořit i v důsledku antibiotické terapie. SCV ale pravděpodobně mohou být i částí normálního životního cyklu stafylokoků, který prochází fází pomalého růstu ve formě SCV a běžného růstu. SCV mají schopnost růst i intracelulárně v neprofesionálních fagocytech (epiteliální buňky, fibroblasty, osteoblasty a endotelie). Ty mají nedostatečnou baktericidní aktivitu. SCV jsou tak chráněny před fagocytózou skutečnými fagocyty a před účinkem antimikrobiálních látek působících extracelulárně. SCV S. aureus mají redukované metabolické procesy a pomalejší růst, což snižuje jejich citlivost k antimikrobiálním látkám. Některé mají i další specifické mechanismy, jako je rezistence k aminoglykosidům a kotrimoxazolu. Rezistence k aminoglykosidům se může vyvinout i v důsledku lokálního používání aminoglykosidu do spaceru, ke kotrimoxazolu po dlouhodobé léčbě tímto přípravkem (33, 39).
Koaguláza negativní stafylokoky (CONS)
Mnoho z nich je běžnou součástí lidského kožního mikrobiomu.
Staphylococcus epidermidis: Je nejčastěji identifikovaný z CONS. IKN způsobuje primárně díky své schopnosti adherovat na materiál endoprotézy a tvořit biofilm. Další z častěji identifikovaných CONS v souvislosti s IKN jsou S. simulans, S. caprae, S. lugdunensis. CONS mohou způsobovat IKN kdykoliv po arthroplastice. U pozdních IKN může být, díky nízké virulenci, bolest jediným příznakem. Rezistence k oxacilinu je u CONS – původců IKN (s výjimkou S. lugdunensis) běžná (2).
Staphylococcus lugdunensis může vyvolávat vážné celkové i lokální infekce podobné infekcím vyvolaným S. aureus. S. lugdunensis většinou neprodukuje β-laktamázu, v důsledku čehož je (na rozdíl od většiny ostatních stafylokoků) citlivý k penicilinu (34). Je popisována možná souvislost s vysokou inquinální kolonizací tímto mikroorganismem (38). Asi třetina pacientů s IKN této etiologie mívá urogenitální abnormity. Většina IKN vyvolaných S. lugdunensis má spíše akutní průběh (41).
Streptokoky
Způsobují méně než 10 % IKN. Z ß-hemolytických streptokoků bývají izolovány zvláště streptokoky skupiny B a G, méně často sk. A a C dle Lancefieldové. Infekce ß-hemolytickými streptokoky mívají akutní průběh, s výjimkou streptokoků skupiny B, které vyvolávají spíše infekce pozdní u pacientů s řadou komorbidit. Předpokládá se hematogenní původ těchto IKN. Zdrojem bývá genitourinární, gastrointestinální trakt a kůže.
Streptococcus gallolyticus subsp. gallolyticus (dříve Streptococcus bovis biotyp I) bývá izolován z hemokultury u pacientů s kolorektálními tumory. U těchto pacientů může být i vyvolavatelem IKN. S. pneumoniae a ostatní viridující streptokoky bývají původci IKN spíše vzácně (2).
Enterokoky
Působí 12–15 % IKN s časným průběhem, často jako součást polymikrobiální infekce. Rovněž mohou vyvolávat infekce hematogenního původu se zdrojem pravděpodobně v gastrointestinálním nebo močovém traktu. Tyto infekce mají většinou prolongovaný průběh odpovídající infekcím vyvolaným méně virulentními mikroorganismy (2).
Aerobní a fakultativně anaerobní gram negativní tyčky
Vyvolávají především IKN s časným průběhem, kde jejich zastoupení může činit až 45 %, často jako součást polymikrobiální infekce. Je uváděno jejich častější zastoupení u infekce kyčelního než kolenního kloubu, což je dáváno do souvislosti s blízkostí gastrointestinálního traktu jako zdroje. Rovněž mohou vyvolávat i hematogenní infekce. Nejčastějším etiologickým agens bývá Escherichia coli a Pseudomonas aeruginosa, dále ostatní zástupci čeledi Enterobacteriaceae (2).
Propionibacterium acnes
Tyto anaerobní gram-pozitivní tyčky jsou běžnou součástí kožní flóry. P. acnes bývá inokulováno do rány v průběhu operace nejčastěji ramenního kloubu. Vzhledem k nízké virulenci se infekce projevuje často jen bolestí, akutní zánět nebývá přítomen. Pacienti mívají v předoperačních vyšetřeních normální hodnoty sedimentace i C reaktivního proteinu (CRP), známky akutního zánětu nebývají přítomny. Nález P. acnes ve vzorcích může být projevem skutečné infekce, pak bývá přítomno ve větším počtu kolonií, nebo jen projevem kontaminace při ojedinělém výskytu (2, 42).
Ostatní anaerobní bakterie
Bývají izolovány asi ve 12 % případů IKN většinou jako součást polymikrobiální infekce. Nejčastějšími původci jsou Clostridium spp., Bacteroides fragilis, Peptostreptococcus spp., Actinomyces spp. Klostridiové IKN (C. septicum, C. perfringens) a infekce B. fragilis bývají u pacientů s gastrointestinálním onemocněním. IKN s účastí peptostreptokoků mohou být odontogenního původu stejně jako infekce vyvolané Actinomyces spp.
Polymikrobiální infekce
Bývají u časných infekcí více zastoupeny než monomikrobiální infekce, zvláště u pacientů starších 65 let s dehiscencí rány. Nejčastěji bývají izolovány enterokoky, S. aureus a aerobní či fakultativně anaerobní gramnegativní tyčky včetně Pseudomonas aeruginosa.
Ostatní bakterie
V ojedinělých případech bývají jako původci izolována korynebakteria, z nichž C. jeikeium je typické svou polyrezistencí k antibiotikům. IKN vyvolané Listeria monocytogens mohou mít se subakutní průběh s výraznou resorpcí okolní kosti (11). Ze zoonotických agens byla z IKN ojediněle izolována Pasteurella multocida v souvislosti s pokousáním či poškrábáním psem nebo kočkou.
Mykobakteria
V rozvinutých zemích byla vzácně popsána jako zdroj IKN v souvislosti s předchozí septickou arthritis etiologie Mycobacterium tuberculosis komplex i bez předchozího onemocnění tuberkulózou. Z netuberkulózních mykobakterií byly ojediněle popsány IKN vyvolané M. avium komplex.
Kultivačně negativní IKN
Kultivačně negativní IKN s příznaky svědčícími pro infekční etiologii mohou být důsledkem předchozí antibiotické terapie, nesprávného použití mikrobiologických postupů nebo neschopností detekovat patogen za použití dostupných diagnostických metod nebo nízkou senzitivitou použitých diagnostických metod. Jejich frekvence se podle různých studií pohybuje od 5 do 35 % (2).
Mykotické komplikace TEP
Infekční komplikace totálních kloubních náhrad mykotickými organismy jsou popisovány vzácně. Nejčastěji jsou vyvolány zástupci rodu Candida (Candida albicans, C. glabrata, C. tropicalis, C. parapsilosis, ostatní raritně), velice vzácně se mohou vyskytovat non-albicans druhy kandid nebo vláknité mikromycety (Aspergillus spp.). Kandidové infekce se vyskytují spíše s delším časovým odstupem od výkonu a postihují převážně pacienty s komorbiditami (imunosuprese, diabetes), často s chirurgickým zákrokem po již prodělané bakteriální komplikaci v anamnéze (3, 15, 27). Diagnóza je založena na kultivačním průkazu mikromycet z peroperačně získaného materiálu (tkáň, kloubní tekutina), nález v materiálu z drenáže je považován za významný do 24 hodin po zákroku. V ostatních případech je třeba zvažovat možnost kolonizace nebo kontaminace vzorku. Související nález kandid v hemokultuře je projevem systémové hematogenní infekce, může být doprovázen těžkým septickým stavem a má výrazně horší prognózu (15, 17).
Lékem volby pro systémové kandidové infekce jsou dle evropských (ESCMID –European Society of Clinical Microbiology and Infectious Diseases), amerických (IDSA –InfectiousDiseases Society ofAmerica ) i českých (CELL – Česká leukemická skupina) doporučení echinokandiny (anidulafungin, caspofungin, micafungin) (5, 9, 24). Jedná se o skupinu fungicidních antimykotik se širokým spektrem účinnosti, minimálními vedlejšími účinky a interakcemi. Za zásadní v případě TEP je považována jejich účinnost i na kandidy rostoucí v biofilmu (9, 15). Flukonazol je možné použít u nekomplikovaných pacientů infikovaných citlivými druhy kandid, kterým nebylo podáno azolové antimykotikum v profylaxi. Za terapeuticky problematické jsou považovány druhy C. krusei, primárně rezistentní k flukonazolu, a C. glabrata, která může být k flukonazolu sekundárně rezistentní a často se jedná o zkříženou azolovou rezistenci.
Většinou bývá echinokandin podáván do doby, než je pacient stabilizován, je kultivačně potvrzena infekce kandidou a stanovena citlivost k antimykotikům (10-14 dnů). Pak lze deeskalovat na flukonazol, nebo (v případě rezistentních druhů) na vorikonazol (C. krusei). Alternativním preparátem je liposomální amfotericin B, který není v ČR k dispozici. Variantou dostupnou v ČR je amfotericin B komplex lipidů, jehož podání je spojeno s častějším výskytem nežádoucích účinků a vyšší toxicitou než u liposomálního derivátu.
Non-albicans druhy kandid jsou obvykle špatně citlivé k flukonazolu, v tomto případě je vhodné podat vorikonazol nebo lipidový derivát amfotericinu B (1). Lékem volby pro infekce vyvolané zástupci rodu Aspergillus je vorikonazol, alternativou opět lipidové deriváty amfotericinu B (16, 28, 40).
Doba léčby je minimálně 6 týdnů a obecně lze říci, že by měla trvat do vymizení klinických, laboratorních i rentgenologických známek infekce (5, 9, 15, 24, 37). Za zásadní pro úspěšné zvládnutí infekce je považováno chirurgické ošetření (resp. výměna implantátu). Interval mezi vynětím implantátu a reimplantací není jednoznačně dán. Kim et al. (15) uvádí medián 4 měsíce s rozmezím 2 – 18 měsíců. Pokud to není možné, je doporučena dlouhodobá sekundární profylaxe, většinou flukonazolem, dle některých autorů i celoživotní. Pro druhy mikromycet necitlivých k flukonazolu přichází v úvahu vorikonazol, posakonazol nebo itrakonazol (individuálně s ohledem na další komorbidity).
Terapeutické monitorování léků (TDM)
Vankomycin
Vankomycin má nefrotoxické a ototoxické nežádoucí účinky. Toto riziko se zvyšuje při délce léčby více než 3 týdny, při dlouhodobě vysoké plazmatické koncentraci a při současném podání dalších přípravků, které narušují funkci ledvin, jako jsou aminoglykosidová antibiotika, kličková diuretika, amfotericin B, nesteroidní antirevmatika a ACE inhibitory.
Úvodní dávka je určena podle aktuální tělesné hmotnosti bez ohledu na renální funkce, protože distribuční prostor vankomycinu je především extracelulární tekutina. Tím se urychlí nástup jeho baktericidního působení dostatečným nasycením tkání (10) (tab. 4).
Vankomycin se z 80-90 % vylučuje nezměněn ledvinami s plazmatickým poločasem 6 hodin při normální funkci ledvin, a proto velikost další dávky a dávkovací interval závisí především na funkci ledvin. Účinnost léčby vankomycinem závisí na celkové expozici vankomycinu během celého dávkovacího intervalu (plocha pod křivkou – AUC), a nikoli pouze na vrcholové hladině, proto je stanovení vrcholových hladin po podání nepřínosné a nedoporučuje se provádět (30).
U nestabilních pacientů (a všech pacientů v intenzivní péči) se doporučuje monitorovat hladiny vankomycinu společně s funkcí ledvin denně nebo obden, u stabilních pacientů na standardním lůžku nejméně 2x týdně. Údolní koncentrace pod 10 mg/l jsou spojeny s větším procentem selhání léčby. Údolní koncentrace nad 20 mg/l jsou spojeny s vysokým rizikem nefrotoxicity. U stabilních pacientů v dobrém stavu je vhodné udržovat cílovou údolní hladinu 10-20 mg/ml, u pacientů v těžkém stavu, s infekcí krevního řečiště, infekční endokarditidou, hlubokými abscesy, spondylodiscitidou, meningitidou nebo pneumonií je nutné udržovat údolní hladiny v rozmezí 15-20 mg/l. Samostatná tabulka 5 je uvedena (vzhledem ke způsobu eliminace vankomycinu) pro pacienty v dialyzačním programu (20) a pro pacienty s peritoneální dialýzou (4) (tab. 5).
Kalkulačka k výpočtu dávek vankomycinu a gentamicinu
Gentamicin
Gentamicin má nefrotoxické a ototoxické nežádoucí účinky. Toto riziko se zvyšuje při délce léčby více než 1 týden, při opakované léčbě aminoglykosidy během předchozích 1-3 měsíců, při dlouhodobě vysoké plazmatické koncentraci (15 mg/l déle než 4 hodiny) a při současném podání dalších preparátů, které narušují funkci ledvin, jako jsou glykopeptidová antibiotika, kolistin, cyklosporin, kličková diuretika, amfotericin B, nesteroidní antirevmatika a ACE inhibitory.
Účinnost aminoglykosidů závisí na vrcholové koncentraci – baktericidní efekt je závislý na poměru Cmax/MIC, tedy čím vyšší vrcholová koncentrace v poměru k minimální inhibiční koncentraci léku, tím větší účinnost. Aminoglykosidy vykazují výrazný postantibiotický efekt, kdy růst mikrobů je inhibován i po poklesu koncentrace léku pod minimální inhibiční koncentraci. Postantibiotický efekt závisí na vrcholové koncentraci a u gramnegativních bakterií může trvat 8-15 hodin. Proto je u gramnegativních bakterií výhodné podání gentamicinu jednou denně, při zhoršené funkci ledvin případně jednou za dva až tři dny.
Nefrotoxicita i ototoxicita (vestibulární i auditorní) aminoglykosidů je způsobena saturací tkání ledvin i vnitřního ucha při nízkých koncentracích a krátkodobá, velmi vysoká koncentrace nemá na saturaci další aditivní vliv. Nefrotoxicita se vyskytuje až u 10 % pacientů léčených gentamicinem a většinou je reverzibilní. Ototoxické nežádoucí účinky jsou většinou ireverzibilní.
První dávka gentamicinu je určena podle ideální (korigované) tělesné hmotnosti, protože distribuční prostor gentamicinu je především extracelulární tekutina (tab. 6). Tím se urychlí nástup jeho baktericidního působení dostatečným nasycením tkání. Gentamicin se z 80-90 % vylučuje nezměněn ledvinami s plazmatickým poločasem 6 hodin při normální funkci ledvin, a proto velikost další dávky a dávkovací interval závisí především na funkci ledvin. Při nitrožilním podání je vhodné gentamicin podávat v infuzi po dobu 30 minut.
Stanovení koncentrace gentamicinu za 6-14 hodin po podání eliminuje možné nepřesnosti při odběru krátce po podání pro stanovení vrcholových hladin. Použití nomogramu umožňuje spolehlivě odhadnout rychlost vylučování a určit další dávkovací interval (31, 32) (obrázek 1). Oproti rozšířenému vyšetřování údolních hladin před podáním další dávky se zde eliminuje riziko nesprávného podání buď příliš velké dávky před dostupností výsledku, nebo naopak významná prodleva v podání další dávky při čekání na výsledek. To nijak nebrání klinikům zkontrolovat dosažení dostatečně nízké údolní hladiny před podáním další dávky stanovením údolní hladiny u pacientů s nestabilní funkcí ledvin nebo jinými faktory, které zvyšují riziko.
Uvedené postupy TDM gentamicinu a vankomycinu jsou používány v Nemocnici České Budějovice, a. s. a byly převzaty ze skotského národního doporučeného postupu se svolením pracovní skupiny Scottish Antimicrobial Prescribing Group (31, 32), která společně s autory výpočetní tabulky a NHS Greater Glasgow and Clyde nenese žádnou odpovědnost za jakékoliv následné úpravy a změny ve výpočetní tabulce.
Kalkulačka k výpočtu dávek vankomycinu a gentamicinu
Vorikonazol
Vorikonazol má široké terapeutické spektrum a interindividuálně rozdílnou geneticky podmíněnou rychlost eliminace. Proto je při dlouhodobé léčbě žádoucí sledovat jeho údolní hladiny, kdy hladiny nad 5,5 mg/l jsou spojeny s vyšším rizikem očních, psychických a kožních nežádoucích účinků, zatímco hladiny pod 2 mg/l jsou spojeny s vyšším rizikem selhání léčby.
Biofilm: Rifampicin a ciprofloxacin
Rifampicin má prokazatelnou protibiofilmovou aktivitu u stafylokoků a zčásti i enterokoků (6, 43). Výhodou uvedených přípravků je možnost perorálního podání. Nevýhodou je jednak častá gastrointestinální intolerance, jednak vysoké riziko lékových interakcí v důsledku indukce jaterních enzymů (cytochromu P450). U gramnegativních původců se za protibiofilmová antibiotika považují fluorochinolony. Problémem je narůstající rezistence proti ciprofloxacinu u řady gramnegativních bakterií.
Průnik antibiotik do tkání kolem infikovaného protetického materiálu
Klinické projevy periprotetické infekce se mohou pohybovat v rozmezí od velmi nenápadného zánětu až po velmi těžce probíhající septické stavy. Ve všech případech je nutné zahájit léčbu podáním antibiotika při horní hranici registrovaného dávkování, a to kvůli rychlému potlačení systémového zánětu a sepse, jsou-li přítomny, ale také pro dosažení co nejvyššího gradientu a co nejlepšího průniku do špatně prokrvených, a tedy špatně dosažitelných (léčitelných) oblastí kolem endoprotézy. Po zvládnutí septického stavu a nasycení kloubních tkání po prvních cca 2 týdnech podávání antibiotik je již možné přejít na udržovací perorální antibiotickou léčbu, která zvýší komfort pacienta a umožní alespoň část léčby absolvovat v domácím prostředí, byť u některých jen dočasně mezi případnými dalšími chirurgickými výkony (35).
Výjimku v nutnosti nitrožilního podání tvoří antibiotika s velmi vysokou biologickou dostupností při perorálním podání, kde nitrožilní podání je opodstatněné v případě septického stavu, zvracení a poruch střevní absorpce či pasáže. Mezi léky, které při dobrém stavu pacienta lze podat perorálně bez ztráty vysoké účinnosti nitrožilního podání, patří kotrimoxazol, linezolid, fluorochinolony, metronidazol a případně klindamycin pro dlouhodobou supresivní léčbu.
Nežádoucí účinky
U všech antibiotik lze očekávat kožní a gastrointestinální nežádoucí účinky různé intenzity a závažnosti. Některé mohou odeznít při pokračování léčby, a proto záleží na klinickém úsudku ošetřujících lékařů, zda se jedná o reakci zvládnutelnou nebo nezvládnutelnou podáním symptomatické léčby, například antiemetik nebo antihistaminik. Nejvýznamnější specifické nežádoucí účinky jsou uvedeny pro každé antibiotikum v tabulce v elektronické verzi doporučeného postupu. Samostatnou, u starší populace velmi významnou hrozbou při dlouhodobé antibiotické léčbě je riziko střevní dysmikrobie, nebo dokonce klostridiové kolitidy. V případě rozvoje průjmů je nutné na tuto závažnou komplikaci myslet a aktivně po ní pátrat. Preventivních opatření z pohledu individuálního pacienta není tolik jako z pohledu hygieny pracoviště a rukou ošetřujícího personálu, ale podávání probiotik, kvalitní nutrice, časná mobilizace, a především včasné propuštění z nemocnice mohou toto riziko snížit.
Diskuse
Tento doporučený postup se nezabývá diagnostikou infekce kloubních náhrad ani způsoby odběru a vyšetření biologického materiálu a jeho úskalími. V současné době existuje několik definic infektu kloubní náhrady, které se z větší části překrývají (22, 23). Poměrně rychle postupuje také vývoj mikrobiologických a molekulárně genetických diagnostických metod. Na rozdíl od toho nová antibiotika přicházejí do klinické praxe nepříliš často a ošetřující lékaři musejí využít do maxima antibiotika, která jim jsou dostupná. Současně se tento doporučený postup nezabývá lokálním podáním antibiotik v nosičích, což je další poměrně dynamická oblast, kde zatím nebylo v odborných kruzích dosaženo všeobecného konsensu.
Registrovaná indikace pro léčbu kostí a kloubů (a podání off-label)
V některých případech jsou uváděna jako léky volby (případně jako alternativní léčba) antibiotika, u kterých není infekce kostí a kloubů uvedena v oddíle Terapeutické indikace v Souhrnu údajů o přípravku. U co-trimoxazolu je dokonce uvedena infekce kostí jako kontraindikce. V případě periprotetické infekce se však jedná o použití výjimečné v situacích, kdy není dostupná lepší alternativa, ve zvýšeném dávkování a v souladu s publikovanými studiemi účinnosti daného antibiotika v této indikaci. Toto podání off-label je podloženo četnými studiemi (uvedeny v seznamu literatury zahraničních doporučených postupů, ze kterých jsme vycházeli), zatímco údaje uvedené v Souhrnu informací o přípravku především u starších antibiotik vycházejí z klinických studií často desítky let starých, a již nereflektují aktuální stav poznání.
Jeden z recenzentů (prof. Beneš) navrhuje sjednocení léčby akutní stafylokokové infekce kloubní náhrady kombinací co-trimoxazol a rifampicin na dvanáctihodinový interval, vzhledem k většímu pohodlí pro pacienta, i když námi navrhované schéma v doporučení považuje za formálně správné. V tomto případě doporučuje podat co-trimoxazol v dávce 1440 mg po 12 hodinách. Stejný recenzent se domnívá, že na udržovací dlouhodobou supresivní léčbu stafylokokové infekce TEP stačí podávat co-trimoxazol v dávce 1x denně a proti streptokokům podávat penicilin V 3x denně a amoxicilin 2x denně. Jeho názor prezentujeme, ale vzhledem k doporučení IDSA (23), ze kterého jsme v tomto případě vycházeli, a ve kterém jsme nechtěli měnit dávkování, ale pouze upravovat antibiotika dle dostupnosti v našem regionu, v předkládaném doporučení ponecháváme dávkování navržené IDSA, vycházející z publikovaných studií.
Závěr
Úspěšná léčba infekce totální kloubní náhrady vyžaduje vždy co nejpřesnější diagnostiku, operační ošetření a dobře cílenou antibiotickou terapii. Dle našeho názoru mají být v souladu se světovým trendem pacienti s periprotetickým infektem léčeni na specializovaném pracovišti, které disponuje multioborovým týmem složeným z ortopedů, mikrobiologů, infektologů a dalších specialistů s dostatečným materiálním zázemím. Vlastní revize infikované náhrady patří do rukou nejzkušenějších lékařů zabývajících se revizemi totálních náhrad. Při dodržení všech zásad je úspěšnost léčby těchto pacientů vysoká. Správná volba antibiotika, jeho dávka a doba podávání je zásadní a měla by být vždy vybrána na základě kultivace a určení citlivosti či rezistence přítomného kmene s nutností použití protibiofilmové složky léčby v případě přítomnosti cizorodého materiálu. Předkládané doporučení není jedinou možnou léčbou pacientů s IKN, ale může být dobrým návodem pro většinu případů. Za velmi užitečné považujeme to, že tento doporučený postup byl schválen čtyřmi odbornými společnostmi.
Důležité poznámky
Preferovaná antibiotika: baktericidní!
Protibiofilmová antibiotika:Nevhodná antibiotika pro kurativní léčbu:
- Staphylococcus: rifampicin
- Gramnegativní bakterie: ciprofloxacin
Monitorování bezpečnosti léčby:
- tetracyklin, doxycyklin, p.o. vankomycin, p.o. cefalosporiny
- obecně platí, že krevní obraz s diferenciálem, jaterní testy, kreatinin, minerály, CRP je třeba kontrolovat minimáilně 1-2x týdně během prvního měsíce léčby a poté 1x za 2-4 týdny; s laboratorní kontrolou vždy kontrola klinická.
Tabulky
Tabulka 1a: Infekce totální endoprotézy - antibiotická kurativní léčba
| Antibiotická kurativní léčba | |||||
| Mikrobiální agens | Úvodní/ pokračo- vací léčba |
Antibiotikum: 1. volba |
Dávka a cesta podání | Antibiotikum: alternativa | Dávka a cesta podání |
| Staphylococcus aureus (MSSA) a plazma-koagulasa-negativní stafylokoky methicilin citlivé |
úvodní terapie | oxacilin + rifampicin1 |
2-3 g à 4 hod. i.v. 450-600 mg à 12 hod. p.o. |
cefazolin + rifampicin1 |
2 g à 8 hod. i.v./ 450-600 mg à 12 hod. p.o. |
| při alergii k β-laktamům: vankomycin + rifampicin1 |
(15 mg/kg à 12 hod.) + dle hladin a schématu i.v./ 450-600 mg à 12 hod. p.o. |
||||
| pokra- čovací terapie | podávat 2 týdny a pokračovat (nelze-li podávat rifampicin, pak i.v. terapie 4-6 týdnů) | ||||
| co-trimoxazol3 + rifampicin1 |
960 mg à 8 hod./ 450-600 mg à 12 hod. p.o. |
levofloxacin3 + rifampicin1 |
500 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||
| ciprofloxacin3 + rifampicin1 |
750 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||||
| linezolid2 + rifampicin1 |
600 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||||
| Staphylococcus aureus (MRSA) a plazma-koagulasa-negativní stafylokoky methicilin rezistentní |
úvodní terapie | vankomycin + rifampicin1 |
(15 mg/kg à 12 hod.) + dle hladin a schématu i.v. 450-600 mg à 12 hod. p.o. |
daptomycin + rifampicin1 |
6-10 mg/kg à 24 hod. i.v./ 450-600 mg à 12 hod. p.o. |
| pokra- čovací terapie | podávat 2 týdny a pokračovat (nelze-li podávat rifampicin, pak i.v. terapie 4-6 týdnů) | ||||
| co-trimoxazol3 + rifampicin1 |
960 mg à 8 hod. p.o./ 450-600 mg à 12 hod. p.o. |
ciprofloxacin3 + rifampicin1 |
750 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||
| levofloxacin3 + rifampicin1 |
500 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||||
| linezolid2 + rifampicin1 |
600 mg à 12 hod. p.o./ 450-600 mg à 12 hod. p.o. |
||||
| teicoplanin + rifampicin1 |
400 mg à 12 hod. 3 dávky, pak à 24 hod. i.v./i.m./ 450-600 mg à 12 hod. p.o. |
||||
| β-hemolytické streptokoky (kromě Streptococcus agalactiae) | úvodní terapie | penicilin G | 5 mil. j. à 4 hod. i.v. | ceftriaxon | 2 g à 12 hod. i.v. |
| při alergii k β-laktamům: vankomycin |
(15 mg/kg à 12 hod.) + dle hladin a schématu i.v. | ||||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| amoxicilin | 1000-1500 mg à 8 hod. p.o. | ||||
| Enterococcus spp. - penicilin citlivý, Streptococcus agalactiae | úvodní terapie | ampicilin + gentamicin4 |
2 g à 4 hod. i.v./ 80 mg à 8 hod. i.v. |
vankomycin, linezolid, daptomycin | i.v./ p.o./ i.v. |
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| amoxicilin | 1000-1500 mg à 8 hod. p.o. | ||||
| Enterococcus spp. - penicilin rezistentní | úvodní terapie | vankomycin | (15 mg/kg à 12 hod.) + dle hladin a schématu i.v. | ||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| linezolid | 600 mg à 12 hod. p.o. | ||||
Tabulka 1b: Infekce totální endoprotézy - antibiotická kurativní léčba (pokračování)
| Mikrobiální agens | Úvodní/ pokračo- vací léčba |
Antibiotikum: 1. volba |
Dávka a cesta podání | Antibiotikum: alternativa | Dávka a cesta podání |
| Enterococcus spp. - vankomycin rezistentní | vyjmutí implantátu nebo celoživotní suprese například doxycyklinem | ||||
| Enterobakterie (E. coli, Klebsiella, Salmonella, Proteus, Enterobacter spp.), Haemophilus spp. | úvodní terapie | ciprofloxacin | 600 mg à 12 hod. i.v./ 750 mg à 12 hod. p.o. | cefotaxim | 2 g à 8 hod. i.v. |
| cefotaxim | 2 g à 8 hod. i.v. | ||||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| ciprofloxacin | 750 mg à 12 hod. p.o. | ||||
| Gramnegativní bakterie - ciprofloxacin rezistentní | úvodní terapie | antibiotikum dle kultivace a citlivosti, např. meropenem | 1-2 g à 8 hod. i.v. | ||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| orální antibiotikum individuálně dle citlivosti původce | p.o. | ||||
| Gramnegativní bakterie - producenti ESBL | úvodní terapie | meropenem | 1-2 g à 8 hod. i.v. | ||
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| ertapenem | 1 g à 24 hod. i.v. | ||||
| Pseudomonas aeruginosa | úvodní terapie | ceftazidim + ciprofloxacin | 2 g à 8 hod. i.v./ 750 mg à 12 hod. p.o. | piperacilin/ tazobactam + ciprofloxacin | 4,5 g à 6 hod. i.v./ 750 mg à 12 hod. p.o. |
| ceftazidim + gentamicin4 | 2 g à 8 hod. i.v./ 240 mg à 24 hod. + dle schématu i.v. | meropenem + ciprofloxacin | 1 g à 8 hod. i.v./ 750 mg à 12 hod. p.o. | ||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| ciprofloxacin | 750 mg à 12 hod. p.o. | ||||
| Anaeroby grampozitivní, Propionibacte- rium acnes, Peptostrepto- coccus, Actinomyces spp., Finegoldia magna) | úvodní terapie | penicilin G + rifampicin |
5 mil. j. à 4 hod. i.v./ 450-600 mg à 12 hod. i.v. | klindamycin + rifampicin |
(600-)900-1200 mg à 6-8 hod. i.v./ 450-600 mg à 12 hod i.v. |
| při alergii k β-laktamům: vankomycin + rifampicin |
(15 mg/kg à 12 hod.) + dle hladin a schématu i.v./ 450-600 mg à 12 hod i.v. | ||||
| pokra- čovací terapie | podávat 2-4 týdny a pokračovat | ||||
| clindamycin + rifampicin |
300-600 mg à 6-8 hod. p.o./ 450-600 mg à 12 hod. p.o. | ||||
| amoxicilin + rifampicin |
1000-1500 mg à 8 hod. p.o./ 450-600 mg à 12 hod. p.o. | ||||
Tabulka 1c: Infekce totální endoprotézy - antibiotická kurativní léčba (pokračování)
| Mikrobiální agens | Úvodní/ pokračo- vací léčba |
Antibiotikum: 1. volba |
Dávka a cesta podání | Antibiotikum: alternativa | Dávka a cesta podání |
| Anaeroby gramnegativní (Fusobacterium spp., Bacteroides spp.) | úvodní terapie | ampicilin + sulbactam |
3 g à 6 hod. i.v. | ||
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| metronidazol | 500 mg à 8 hod. p.o. | amoxicilin/ klavulanová kyselina | 2 g à 12 hod. p.o. | ||
| Bez průkazu agens | úvodní terapie | vancomycin + levofloxacin (event. ciprofloxacin) + rifampicin1 | (15 mg/kg à 12 hod.) + dle hladin a schématu i.v./ 500 mg à 12 hod. i.v./ p.o./ 450-600 mg à 12 hod. i.v. | ampicilin/ sulbaktam | 3 g à 6 hod. i.v. |
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| levofloxacin (event. ciprofloxacin) + rifampicin1 | 500 mg à 12 hod. i.v./ p.o./ 450-600 mg à 12 hod. p.o. | amoxicilin/ klavulanová kyselina | 2 g à 12 hod. p.o. | ||
| Korynebakterie | úvodní terapie | vancomycin | (15 mg/kg à 12 hod.) + dle hladin a schématu i.v. | ||
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| orální antibiotikum dle citlivosti | p.o. | ||||
| Kvasinky rodu Candida | úvodní terapie | echinokandin: anidulafungin nebo caspofungin nebo mikafungin | 1. den 200 mg, pak 100 mg à 24 hod. i.v., resp. 1. den 70 mg, pak 50 mg à 24 hod. i.v., resp. 100 mg à 24 hod. i.v. 10-14 dní | ||
| následně: flukonazol (stabilizovaný pacient, citlivá kandida) | 1. den 800 mg à 24 hod., pak 400 mg à 24 hod. (min. 6 mg/kg/den) i.v. 14 dní | ||||
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| flukonazol (pokud je citlivá kandida) | 400 mg à 24 hod. (min. 6 mg/kg/den) i.v. | pokud je C. krusei: vorikonazol | 1. den 400 mg à 12 hod., pak 200 mg à 12 hod. p.o. | ||
| amfotericin B lipidový derivát5 | 5 mg/kg/den i.v. | pak: flukonazol | 400 mg à 24 hod. (min. 6 mg/kg/den) i.v., pak p.o. | ||
| Candida druhů non-albicans | úvodní terapie | amfotericin B na lipidovém nosiči | i.v. | vorikonazol | i.v., popř. pak p.o. |
| následně: flukonazol (stabilizovaný pacient, citlivá kandida) | 1. den 800 mg à 24 hod., pak 400 mg à 24 hod. (min. 6 mg/kg/den) i.v. 14 dní | ||||
| pokra- čovací terapie | podávat 2 týdny a pokračovat | ||||
| podle citlivosti: flukonazol, vorikonazol | p.o. (min. 6 týdnů) | ||||
1 rifampicin - nikdy v monoterapii a pouze při přítomnosti cizorodého materiálu;
redukce dávky u pacientů nad 75 let na 2x 300 mg
2 linezolid - maximální doba podávání 4 týdny
3 methicilin rezistentní Staphylococcus aureus by neměl být léčen ciprofloxacinem či levofloxacinem, vzhledem k vysoké rezistenci či riziku jejího vzniku v průběhu terapie. Nutno sledovat regionální rezistenci stafylokoka (ciprofloxacin/co-trimoxazol/levofloxacin).
Nikdy monoterapie chinolony u rodu Staphylococcus!
4 monitoring clearance kreatininu, dávka dle schématu v příloze
5 v ČR dostupný amfotericin B - lipidový komplex (Abelcet)
červeně označené mikroorganismy - obtížně léčitelné
Tabulka 2: Doba antibiotické léčby podle typu výkonu
| Typ výkonu | Lokalizace, další upřesnění | Doba léčby |
| Časná revize s ponecháním implantátu | kyčel, rameno, loket | 3 měsíce |
| koleno | až 6 měsíců | |
| Jednoduchá výměna | kyčel, koleno | 6 týdnů až 3 měsíce |
| Dvoudobá výměna | po extrakci - spacer | 4-6 týdnů |
| po reimplantaci - cementovaná TEP (antibiotikum v cementu) |
2-6 týdnů | |
| po reimplantaci - necementovaná TEP | 6 týdnů |
Tabulka 3: Infekce totální endoprotézy - chronická supresivní léčba
| Chronická supresivní léčba | |||||
| Mikrobiální agens | Antibiotikum: 1. volba |
Dávka | Antibiotikum: alternativa | Dávka | |
| Staphylococcus aureus (MSSA) | cefadroxil | 500 mg à 12 hod. p.o. | klindamycin | 300 mg à 6-8 hod. p.o. | |
| co-trimoxazol | 960 mg à 12 hod. p.o. | ||||
| amoxycilin/ klavulanová kyselina | 2 g à 12 hod. p.o. | ||||
| ampicilin/ sulbaktam | 750 mg à 12 hod. p.o. | ||||
| doxycyklin | 100 mg à 12 hod. (resp. 200mg à 24 hod.) p.o. | ||||
| Staphylococcus aureus a MRSA | co-trimoxazol | 960 mg à 12 hod. p.o. | doxycyklin | 100 mg à 12 hod. (resp. 200mg à 24 hod.) p.o. | |
| Streptococcus spp. | penicilin V | 500 mg à 6 hod. p.o. | amoxycilin | 500 mg à 8 hod. p.o. | |
| Enterococcus spp. citlivý na penicilin | amoxycilin | 500 mg à 8 hod. p.o. | |||
| Enterobakterie | co-trimoxazol | 960 mg à 12 hod. p.o. | dle citlivosti původce | ||
| Pseudomonas aeruginosa | ciprofloxacin | 500 mg à 12 hod. p.o. | |||
| Propionibacterium spp. | amoxycilin | 500 mg à 8 hod. p.o. | penicilin V | 500 mg à 6 hod. p.o. | |
Tabulka 4: Určení dávky vankomycinu – úvodní a udržovací léčba
Určení první dávky
| ||||||||||||||||
| ||||||||||||||||
| ||||||||||||||||
|
| ||||||||||
Dávkování vankomycinu - hemodialýza
| ||||||||||
| ||||||||||
|
Určení první dávky
| Clearance kreatininu (ml/s) | Tělesná hmotnost | ||||
| 40-49 kg | 50-59 kg | 60-69 kg | 70-79 kg | >80 kg | |
| <0,33 | 2,5 mg/kg (max. 180 mg) a poté zkontrolujte sérovou koncentraci gentamicinu po 24 hodinách | ||||
| 0,33-0,49 | 180 mg po 48 hod | 200 mg po 48 hod | 240 mg po 48 hod | 240 mg po 48 hod | 260 mg po 48 hod |
| 0,50-0,65 | 200 mg po 48 hod | 240 mg po 48 hod | 280 mg po 48 hod | 300 mg po 48 hod | 320 mg po 48 hod |
| 0,66-0,84 | 240 mg po 48 hod | 280 mg po 48 hod | 320 mg po 48 hod | 360 mg po 48 hod | 400 mg po 48 hod |
| 0,85-1,00 | 200 mg po 24 hod | 240 mg po 24 hod | 280 mg po 24 hod | 300 mg po 24 hod | 320 mg po 24 hod |
| >1,00 | 240 mg po 24 hod | 280 mg po 24 hod | 320 mg po 24 hod | 360 mg po 24 hod | 400 mg po 24 hod |
- Dle aktuální hmotnosti a clearance kreatininu
- 30minutová infuze se záznamem času počátku aplikace gentamicinu do dekursu
| Za 6-14 hodin od počátku aplikace gentamicinu (se záznamem času odběru) ke stanovení sérové hladiny gentamicinu |
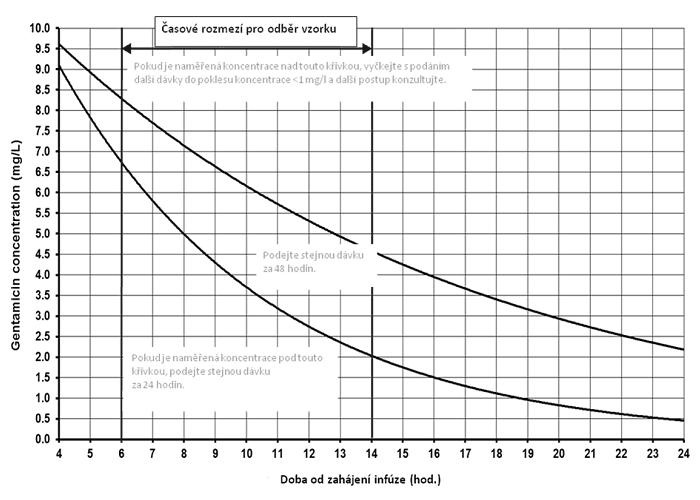
Obr. 1: Nomogram k stanovení dávky gentamicinu podle sérové koncentrace stanovené v určitém intervalou od předchozího podání
(svislé linky ohraničují interval nejvhodnější pro odběr vzorku)
| Monitorování koncetrace gentamicinu v případě clearance kreatininu nad 0,33 ml/s |
|
| Monitorování hladin gentamicinu podle závažnosti stavu, stupně poruchy funkce ledvin a (ne)stability funkce ledvin provádět denně, obden nebo 2x týdně, s následnou úpravou dávky a intervalu |
| Monitorování koncetrace gentamicinu v případě clearance kreatininu pod 0,33 ml/s |
|
Tabulka 7a: Antibiotika - vlastnosti a cena
| Antibiotikum | indikace pro kosti a klouby v SPC | denní dávka | vybrané nežádoucí účinky* | hlavní kontraindi- kace** | redukce dávky při renální dysfunkci *** | redukce dávky při jaterní dysfunkci *** | nejvýznam- nější lékové interakce | orient. cena za týden léčby (tis.Kč) |
| oxacilin | ne, ano pro dise- minované infekce | 18 g | hepatitida, pruritus, agranulocytóza, zmatenost | ne | ne, ale opatrně | 9 | ||
| rifampicin | ano, těžké stafyloko- kové infekce v kombinaci | 1200 mg (SPC uvádí 900 mg) | hemolytická anémie, trombocyto- penie, hepatitida, oranžové tělesné tekutiny, renální selhání, pruritus | těžká jaterní dysfunkce, probíhající hepatitida | ano | ano | velmi časté: co-trimoxazol, antiepileptika, anitpsychotika, antimykotika, antivirotika, warfarin, kortikoidy a estrogeny (antikoncepce), betablokátory, antidiabetika, statiny, thyr- oxin, imunosu- presiva | 0,1 |
| cefazolin | ano, těžké infekce a osteo- myelitida | 6 g | ne | riziko renálního selhání při kombinaci s furosemidem nebo gentamicinem | 4 | |||
| vankomycin | ano | 2 g | nefrotoxicita, ototoxicita, syndrom rudého muže | ano, monitoro- vání hladin*** | ne | 7 | ||
| levofloxacin p.o. | ne | 1000 mg | prodloužení QT intervalu, arytmie, křečová pohotovost, insomnie, úzkost a zmatenost, ruptura šlach, dekompenzace diabetu, neuropatie, hepatitida | děti a dospívající, epilepsie, těhotenství a kojení, entezopatie po předchozím podání chinolonů, myasthenia gravis | ano | ne | warfarin, antiarytmika, tricyklická antidepresiva, makrolidy, antipsychotika (QT interval) | 1 |
| levofloxacin i.v.* | ne | 1000 mg | ano | ne | 9 | |||
| ciprofloxacin p.o. | ano v kombinaci, max. 3 měsíce | 1500 mg | křečová pohotovost, anorexie, zmatenost, deprese, ruptura šlachy, artropatie, neuropatie optiku | epilepsie, těhotenství a kojení, entezo- patie po předcho- zím podání chinolonů, myasthenia, rel.: děti a dospívající | ano | ne | teofylin, anitarytmika, warfarin, klozapin, olanzapin, duloxetin, metotrexát, sildenafil, vápník, hořčík | 0,2 |
| ciprofloxacin i.v. | 1200 mg | ano | ne | 6 | ||||
| co-trimoxazol | ne, osteo- myelitida je uvedena jako kontra- indikace | 2880 mg | myelosuprese, fototoxicita, renální selhání, hyperkalémie, porucha zraku, pruritus | erytema multiforme, trombopenie, granulocyto- penie, mega- loblastická anémie, těž- ká porucha funkce jater nebo ledvin | ano | ne | warfarin, perorální antidiabetika, fenytoin, digoxin, rifampicin | 0,1 |
Tabulka 7b: Antibiotika - vlastnosti a cena (pokračování)
| Antibiotikum | indikace pro kosti a klouby v SPC | denní dávka | vybrané nežádoucí účinky* | hlavní kontraindi- kace** | redukce dávky při renální dysfunkci *** | redukce dávky při jaterní dysfunkci *** | nejvýznam- nější lékové interakce | orient. cena za týden léčby (tis.Kč) |
| linezolid i.v. | ne | 1200 mg | myelosuprese: anémie, leukopenie, trombocyto- penie; laktátová acidóza, neuropatie optiku, periferní neuropatie, serotoninový syndrom, vzestup jaterních testů | určité lékové interakce, karcinoid, feochromo- cytom, tyreotoxikóza, bipolární deprese, schizoafektivní porucha, akutní zmatenost, těhotenství a kojení, max. doba léčby 28 dní | ne | ne | inhibitory monoamino- oxidázy, triptany, SSRI, sympatomi- metika, vasopresory, pethidin, buspiron; potraviny obsahující tyramin | 19 |
| linezolid p.o. | ne | 1200 mg | ne | ne | 19 | |||
| daptomycin | ne, ano při bakteriémii | 500 mg (6 mg/kg), off label až 10 mg/kg | rhabdomyolýza (CK), eosinofilní pneumonitida, hepatotoxicita, periferní neuropatie, úzkost | ano | ne, zvýšená pozorost při jaterní dekom- penzaci | warfarin (INR), statiny (vysadit), nesteroidní antirevmatika | 31 | |
| teicoplanin | ano | 800 mg | nefrotoxicita, ototoxicita, trombocyto- penie | ano, monitoro- vání hladin** | ne | 13 | ||
| ceftriaxon | ano | 4 g | trombopenie, agranulocytóza | ano | ne | 5 | ||
| ampicilin i.v. | ne | 12 g | těžká jaterní insuficience | ano | kontra- indikováno | alopurinol, warfarin | 6 | |
| amoxicilin p.o. | ne | 4,5 g | ano | ne | warfarin, digoxin, metotrexat | 0,2 | ||
| cefotaxim | ano | 8 g | ano | ne | 7 | |||
| meropenem | ne | 6 g | hepatotoxicita, trombocytóza, bolesti hlavy | ano | ne | valproát, warfarin | 17 | |
| ertapenem | ne | 1 g | snížení křečo- vého prahu, nespavost, zmatenost, hepatotoxicita, trombocytóza | těžká porucha funkce ledvin, dialýza | kontra- indikována | ne | valproát | 9 |
| ceftazidim | ano | 8 g | eosinofilie, trombocytóza, hepatotoxicita | ano | ne | 13 | ||
| gentamicin | ano, tam kde nejsou jiná méně toxická ATB | 320 mg | nefrotoxicita, ototoxicita, křeče, polyneuropatie | myasthenia gravis, těžká porucha sluchu | ano, monitoro- vání hladin*** | ne | 0,8 | |
| penicilin G | ano | 30 MIU | křeče, hyperkalémie | relativní: hyperkalémie, těžká renální dysfunkce | ano | ne | warfarin, chlorpromazin, probenecid | 5 |
Tabulka 7c: Antibiotika - vlastnosti a cena (pokračování)
| Antibiotikum | indikace pro kosti a klouby v SPC | denní dávka | vybrané nežádoucí účinky* | hlavní kontraindi- kace** | redukce dávky při renální dysfunkci *** | redukce dávky při jaterní dysfunkci *** | nejvýznam- nější lékové interakce | orient. cena za týden léčby (tis.Kč) |
| klindamycin i.v. | ano | 3600 mg (max. dávka dle SPC je 2700 mg/d) | eosinofilie, neutropenie, trombocyto- penie, hepatitida | relativní: myasthenia gravis | možná ano | ano | warfarin | 10 |
| klindamicin p.o. | ano | 1800 mg | eosinofilie | ne | ano | warfarin | 0,3 | |
| metronidazol i.v. | ano | 1500 mg | periferní neuropatie, křeče, závratě, zmatenost, myelosuprese, myalgie | ne | ano při těžkém postižení jater | alkohol (anta- busový efekt), takrolimus, warfarin, lithi- um, fenytoin, karbamazepin, cyklosporin, amiodaron (prodloužení QTc) | 3 | |
| cefepim | ne, ano při bakteriémii | 4 g | neuropatie, zmatenost, aplastické anémie, hemolytická anémie, krvácení, hepatitida | ano | ne | warfarin, antiagregancia, alkohol | 11 | |
| amoxycilin/ klavulanát | ano | 4,8 g (dle SPC max. dávka 3,6 g) | krystalurie a neprůchodnost močového katetru, neutropenie, trombocyto- penie, hepatitida, křeče | ano | ne, ale nutný monitoring | alopurinol, warfarin, metotrexat, mykofenolat mofetil | 4 | |
| ampicilin/ sulbactam | ano | 12 g | myelosuprese, hyperbiliru- binémie, hepatitida | ano | ne, ale nutný monitoring | alopurinol, warfarin, metotrexat | 5,5 | |
| piperacilin/ tazobactam | ne | 18 g | neutropenie, trombocyto- penie, anémie, hepatitida, hyperbili- rubinémie, zvýšená krvá- civost, křeče, hypokalémie | ano | ne | myorelaxancia, warfarin, metotrexat | 13 | |
| colistin | ano, tam kde nejsou jiná méně toxická ATB | 9 MIU | neurotoxicita včetně závratí, křečí a zmatenosti, poruchy zraku, parestézie jako první známka předávkování, nefrotoxicita | relativní: myasthenia gravis | ano | ne | myorelaxancia | 7 |
Tabulka 7d: Antibiotika - vlastnosti a cena (pokračování)
| Antibiotikum | indikace pro kosti a klouby v SPC | denní dávka | vybrané nežádoucí účinky* | hlavní kontraindi- kace** | redukce dávky při renální dysfunkci *** | redukce dávky při jaterní dysfunkci *** | nejvýznam- nější lékové interakce | orient. cena za týden léčby (tis.Kč) |
| anidulafungin | ne, ano pro disemino- vané infekce | 100 mg | dobrá tolerance, kožní projevy, dušnost, zvýšené jaterní testy, bilirubin, horečka, únava, poruchy funkce ledvin, změny v krevním obraze, reakce v místě vpichu | fruktózová intolerance, relativní těhotenství, laktace | ne | ne při lehké a střední poruše funkce | nevýznamné | 45 |
| caspofungin | ne, ano pro disemino- vané infekce | 50 mg | relativní: těhotenství, laktace | ne | ano, při středně těžké poruše snížit udržovací dávku na 35 mg denně | cyklosporin, takrolimus | 50 | |
| micafungin | ne, ano pro disemino- vané infekce | 100 mg | relativní: těhotenství, laktace | ne | ne při lehké a střední poruše funkce, nepodávat při těžší poruše | amfotericin B, sirolimus, nifedipin, itrakonazol | 55 | |
| amfotericin B | ne, ano pro disemino- vané infekce | dle váhy | nefrotoxicita, hepatotoxicita, srdeční poru- chy, poruchy dýchání, hematotoxicita, hypotenze, minerálová disbalance, reakce při po- dání, exantém, anafylaktický šok, orgánové selhání , méně u lipidových derivátů | renální a jaterní dysfunkce, těhotenství, laktace | nefrotoxic- ký - při podání pečlivě monitoro- vat funkce a iontogram | hepato- toxický - při podání pečlivě monitoro- vat funkce | léky s rizikem nefrotoxicity a hepatotoxicity | 50-60 |
* Vybrané nežádoucí účinky: u všech vyrážka, bolesti hlavy, nechutenství, poruchy zažívání (průjmy, nausea, zvracení), zánět v místě infuze, klostridiová kolitida, anafylaktické reakce, kvasinkové superinfekce, střevní dysmikrobie, rozvoj rezistence
** Kontraindikace: vždy předchozí alergická reakce na účinnou nebo pomocné látky, nebo na látky příbuzné (hlavně u β-laktamů)
*** Redukce dávky při renální či jaterní dysfunkci: dle SPC, u některých léků již při lehkém postižení a dále proporcionálně, u některých až při velmi pokročilém postižení, samostatnou kapitolou jsou vankomycin, gentamicin, teicoplanin a vorikonazol, kde je třeba monitorovat lékové hladiny
Uváděné ceny antibiotik jsou vypočteny pro dávkování uvedené v doporučeném postupu podle orientační prodejní ceny léku dle úhradové vyhlášky Státního ústavu pro kontrolu léčiv (http://www.sukl.cz/modules/medication/) v prosinci 2016 a obvyklé ceny infuzních setů a dalšího spotřebního materiálu v případě nitrožilního podání, bez započtění ceny práce zdravotníků. Skutečné nákupní ceny antibiotik a spotřebního materiálu se mohou významně lišit.
Biologická dostupnost: ciprofloxacin, levofloxacin, linezolid, metronidazol, co-trimoxazol, klindamycin (a vorikonazol) mají téměř 100% biologickou dostupnost při perorálním podání, proto i.v. forma se využívá jen tam, kde nelze podat perorálně. Biologická dostupnost tablet je až 99-100 % (ciprofloxacin 80 %, tedy 400 mg i.v. = 500 mg p.o.).
Literatura
- Arendrup MC, Boekhout T, Akova M et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of rare invasive yeast infections European Society of Clinical Microbiology and Infectious Diseases Fungal Infection Study Group. Clin Microbiol Infect 2014;20(Suppl 3):76-98.
- Aaron J. Tande, Robin Patel. Prosthetic Joint Infection. Clinical Microbiology Reviews 204;27:302–345.
- Bartalesi F., Fallani S., Salomoni E. et al. Candida glabrata prosthetic hip infection. Am J Orthop (Belle Mead NJ) 2012;41(11):500-505.
- Bednářová V, Dusilová Sulková S a kol. Peritoneální dialýza. 2. rozšířené vydání, Praha: Maxdorf, 2011.
- Cuenca-Estrella M, Verweij PE, Arendrup MC et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: diagnostic procedures. Clin Microbiol Infect 2012;18(Suppl 7):9-18.
- El Helou OC, Berbari EF, Lahr BD et al. Efficacy and safety of rifampin containing regimen for staphylococcal prosthetic joint infections treated with debridement and retention. Eur J Clin Microbiol Infect Dis 2010;29:961–67.
- Gallo J, Landor I, Vavřík P. Současné možnosti prevence infekcí kloubních náhrad. Acta Chir orthop Traum čech 2006;73:229-236.
- Gallo J. Předoperační diagnostika infekcí kloubních náhrad. Ortopedie 2017;11(2):75-81.
- Haber J, Ráčil Z, Drgoňa L et al. Léčba invazivního kandidového onemocnění a hematogenní kandidové infekce - doporučení odborníků s podporou CELL. Postgraduální medicína 2014;16(příl.3):11-13.
- Holmes NE, Turnidge JD, Munckhof WJ et al. Vancomycin AUC/MIC ratio and 30-day mortality in patients with Staphylococcus aureus bacteremia. Antimicrob Agents Chemother 2013;57(4):1654-1663.
- Chrdle A, Stárek M. Listeriový infekt umělé kloubní náhrady. Klin Mikrobiol Inf Lék 2011;17(2):62-66.
- Jahoda D, Nyč O, Pokorný D, Landor I, Sosna A. Antibiotika v prevenci infekčních komplikací u operací kloubních náhrad. Acta Chir orthop Traum čech 2006;73:108-114.
- Jahoda D, Nyč O, Šimsa J, Kučera E, Hanek P, Chrz P, Pokorný D, Tawa N, Landor I, Sosna A. Výskyt pozdní hematogenní infekce kloubních náhrad v našem souboru a návrh systému prevence. Acta Chir orthop Traum čech 2007;74:397-400.
- Kapadia BH, Berg RA, Daley JA, Fritz J, Bhave A, Mont MA. Periprosthetic joint infection. Lancet 2016;387:386–94.
- Kim SJ, Huh J, Odrobina R, Kim JH. Systemic review of published literature on Candida infection following total hip arthroplasty. Mycopathologia 2015;179:173-185.
- Koehler P, Tacke D, Cornely OA. Aspergillosis of bones and joints – a review from 2002 until today. Mycoses 2014;57:323–335.
- Leroux S, Ullmann AJ. Management and diagnostic guidelines for fungal diseases in infectious diseases and clinical microbiology: critical appraisal. Clin Microbiol Infect 2013;19(12):1115–1121.
- Liu C, Bayer A, Cosgrove SE et al. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin Infect Dis 2011;52(3):18-55.
- Marculescu CE, Berbari EF, Hanssen AD, et al. Outcome of prosthetic joint infections treated with debridement and retention of components. Clin Infect Dis 2006;42:471–78.
- Novák I, Matějovič M, Černý V. a kol. Akutní selhání ledvin a eliminační techniky v intenzivní péči, Praha: Maxdorf 2008.
- Musil D, Stehlík J, Abrman K. Algoritmus diagnostiky a léčby u infekce totálních náhrad. Ortopedie 2017;11(2):89-96.
- Ochsner PE, Borens O, Bodler P et al. Infections of the musculosceletal system. Basic principles, prevention, diagnosis and treatment. Grandvaux, Switzerland, 2014.
- Osmon DR, Berbari EF, Berendt AR et al. Diagnosis and management of prosthetic joint infection: Clinical practice guidelines by the infectious diseases society of America. Clin Infect Dis 2013;56(1):1-25.
- Pappas PG, Kauffman CA, Andes DR et al. Executive Summary: Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis 2016;62(4):409-417.
- Pappas PG, Kauffman CA, Andes DR et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious DiseasesSociety of America. Clin Infect Dis 2015;48-5:1-50.
- Pappas PG, Kauffman CA, Andes DR et al. Clinical practice guidelines for the management of candidiasis update by the Infectious Diseases Society of America. Clin Infect Dis 2009;48-5:503-35.
- Phelan DM, Osmon DR, Keating MR et al. Delayed reimplantation arthroplasty for candidal prosthetic joint infection: a report of 4 casesand review of the literature. Clin Infec Dis 2002;34:930–8.
- Račil Z, Kocmanova I, Haber J et al. Lečba invazivni aspergilózy – doporučení odborníků s podporou CELL. Postgraduální medicína 2014;16:3.
- Rao N, Crossett LS, Sinha RK, Le Frock JL. Long-term suppression of infection in total joint arthroplasty. Clin Orthop Relat Res 2003;414:55–60.
- Rybak M, Lomaestro B, Rotschafer JC et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Am J Health Syst Pharm 2009;66:82–98.
- Scottish Antimicrobial Prescribing Group Guidance: Available at https://www.scottishmedicines.org.uk/files/sapg/SAPG_Intravenous_vancomycin_adults_Pulsed_infusion_.pdf. Accessed on 22 April 2015.
- Scottish Antimicrobial Prescribing Group Guidance: Available at http://www.scottishmedicines.org.uk/SAPG/Quality_Improvement/Greater_Glasgow_and_Clyde. Accessed on 28 January 2016.
- Sendi P, Rohrbach M, Graber P, Frei R, Ochsner PE, Zimmerli W. Staphylococcus aureus small colony variants in prosthetic joint infection. Clin Infect Dis 2006;43:961–967.
- Tan TY, Ng SY, He J. Microbiological characteristics, presumptive identification, and antibiotic susceptibilities of Staphylococcus lugdunensis. J Clin Microbiol 2008;46:2393–2395.
- Tice AD, Rehm SJ, Dalovisio JR et al. Practice guidelines for outpatient parenteral antimicrobial therapy. IDSA guidelines. Clin Infect Dis 2004;38:1651–72.
- Trampuz A, Zimmerli W. Prosthetic joint infections: update in diagnosis and treatment. Swiss Med Wkly. 2005;135:243-251.
- Ueng SW, Lee CY, Hu CC et al. What is the success of treatment of hip and knee candidal periprosthetic joint infection? Clin Orthop Relat Res 2013;471:3002–3009.
- van der Mee-Marquet N, Achard A, Mereghetti L, Danton A, Minier M, Quentin R. Staphylococcus lugdunensis infections: high frequencyof inguinal area carriage. J Clin. Microbiol 2003;41:1404–1409.
- Vaudaux P, Kelley WL, Lew DP. Staphylococcus aureus small colony variants: Difficult to diagnose and difficult to treat. Clin Infect Dis 2003;43:8:968-970.
- Walsh TJ, Anaissie EJ, Denning DW et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008;46(3):327-60.
- Weightman NC, Allerton KE, France J. Bone and prosthetic joint infection with Staphylococcus lugdunensis. J Infect 2000;40:98–99.
- Zeller V, Ghorbani A, Strady C, Leonard P, Mamoudy P, Desplaces N. Propionibacterium acnes: an agent of prosthetic joint infection and colonization. J Infect 2007;55:119–124.
- Zimmerli W, Frei R, Widmer AF, Rajacic Z. Role of rifampin for treatment of orthopedic implant-related staphylococcal infections: a randomized controlled trial. Foreign Body Infection (FBI) Study Group. JAMA 1998;279:1537-41.
- Zimmerli W, Trampuz A, Ochsner PE. Prosthetic-joint infections. N Engl J Med 2004;351:1645–54.
Poděkování
Děkujeme všem recenzentům za jejich připomínky, které vedly ke zlepšení předkládaného doporučení. Za cenné podněty děkujeme prof. MUDr. Jiřímu Benešovi, CSc. a doc. MUDr. Olze Džupové, Ph.D. z Infekční kliniky 3. LF UK a Nemocnice Na Bulovce, MUDr. Adamu Vitoušovi z Infekčního oddělení Krajské nemocnice Liberec, a.s. a MUDr. Lence Vojtilové, Ph.D. z Kliniky infekčních chorob FN Brno a doc. MUDr. Hanuši Rozsypalovi, CSc. z Kliniky infekčních a tropických nemocí 1. LF UK a Nemocnice Na Bulovce.