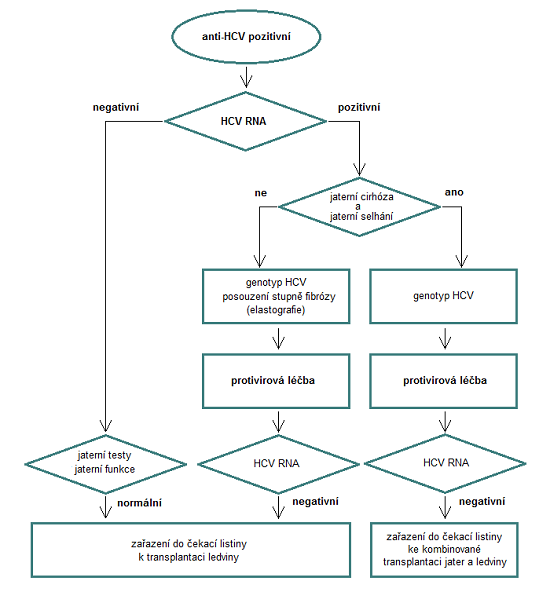
Obrázek 1: Praktický postup před zařazením do čekací listiny k transplantaci ledviny u anti-HCV pozitivních pacientů (v roce 2016)
Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
Pracovní skupina pro virové hepatitidy České hepatologické společnosti České lékařské společnosti J. E. Purkyně,
Pracovní skupina pro virové hepatitidy Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně
Autoři:
| Prof. MUDr. Petr Urbánek, CSc. | Interní klinika 1. lékařské fakulty UK a ÚVN Praha |
| Prof. MUDr. Petr Husa, CSc. | Klinika infekčních chorob Lékařské fakulty MU a FN Brno |
| MUDr. Jan Šperl, CSc. | Klinika hepatogastroenterologie IKEM Praha |
| MUDr. Soňa Fraňková | Klinika hepatogastroenterologie IKEM Praha |
| Doc. MUDr. Stanislav Plíšek, Ph.D. | Infekční klinika Lékařské fakulty UK a FN Hradec Králové |
| Doc. MUDr. Luděk Rožnovský, CSc. | Klinika infekčního lékařství FN Ostrava |
| MUDr. Petr Kümpel | Infekční oddělení Slezské nemocnice Opava |
Schváleno
Obsah
Preambule
1. Epidemiologie HCV
1.1. Prevence přenosu HCV
2. Přirozený průběh HCV infekce
3. Laboratorní vyšetřovací metody
3.1. Sérologické detekční metody
3.2. Molekulárně genetické metody
3.3. Genetické vyšetření infikované osoby
4. Screening HCV infekce
5. Diagnostická kritéria
5.1. Akutní HCV infekce
5.2. Chronická HCV infekce
6. Vyšetření před zahájením protivirové léčby
6.1. Chronická HCV infekce
6.2. Stanovení pokročilosti jaterního postižení
6.3. Virologické parametry
7. Indikace zahájení terapie: Kdo by měl být léčen?
8. Kontraindikace zahájení terapie chronické HCV infekce
9. Cíle terapie chronické infekce virem hepatitidy C
10. Dostupná protivirová léčba
10.1. Sofosbuvir
10.2. Fixní kombinace sofosbuviru a ledipasviru
10.3. Fixní kombinace sofosbuviru a velpatasviru
10.4. Dasabuvir, ombitasvir, paritaprevir/ritonavir (kombinace 3D)
10.5. Grazoprevir a elbasvir
10.6. Daclatasvir
10.7. Simeprevir
10.8. Ribavirin
11. Terapie HCV infekce
11.1. Genotyp HCV 1
11.1.1. Léčebná varianta 1: sofosbuvir/ledipasvir
11.1.2. Léčebná varianta 2: sofosbuvir/velpatasvir
11.1.3. Léčebná varianta 3: ombitasvir + paritaprevir/ritonavir + dasabuvir (3D)
11.1.4. Léčebná varianta 4: grazoprevir/elbasvir
11.1.5. Léčebná varianta 5: sofosbuvir + daclatasvir
11.2. Genotyp HCV 2
11.2.1. Léčebná varianta 1: sofosbuvir + velpatasvir
11.2.2. Léčebná varianta 2: sofosbuvir + daclatasvir
11.3. Genotyp HCV 3
11.3.1. Léčebná varianta 1: sofosbuvir/velpatasvir
11.3.2. Léčebná varianta 2: sofosbuvir + daclatasvir
11.3. Genotyp HCV 4
11.4.1. Léčebná varianta 1: sofosbuvir/ledipasvir
11.4.2. Léčebná varianta 2: sofosbuvir/velpatasvir
11.4.3. Léčebná varianta 3: ombitasvir + paritaprevir/ritonavir (2D)
11.4.4. Léčebná varianta 4: grazoprevir/elbasvir
12. Monitorování léčby HCV infekce
12.1. Monitorování účinnosti léčby
12.2. Monitorování bezpečnosti léčby
12.3. Monitorování lékových interací během léčby HCV infekce
13. Metody zvýšení adherence pacientů k léčbě
14. Péče o pacienty s dosaženou SVR
15. Léčba pacientů s hepatocelulárním karcinomem bez indikace k transplantaci jater
16. Léčba pacientů s pokročilým jaterním onemocněním
16.1. Kompenzovaná jaterní cirhóza
16.2. Pacienti indikovaní k transplantaci jater
16.3. Pacienti po transplantaci jater
16.4. Pacienti indikovaní k transplantaci jater
17. Opakovaná léčba pacientů bez SVR
17.1. Po terapii PEG-IFN + RBV + telaprevir/boceprevir/simeprevir
17.2. Po terapii čistě perorálním režimem DAA
18. Léčba pacientů s komorbiditami nebo akutní HCV infekcí
18.1. Koinfekce HBV/HCV
18.2. Osoby s extrahepatálními manifestacemi HCV infekce
18.3. Pacienti v pravidelném dialyzačním léčení
18.3.1. Diagnostika HCV infekce u pacientů s onemocněním ledvin
18.3.2. Terapeutické možnosti
18.4. Příjemci orgánových štěpů
18.5. Hemofilici
18.6. Aktivní uživatelé drog
18.7. Akutní HCV infekce
18.8. Pacienti s koinfekcí HCV + HIV
18.8.1. Základní fakta
18.8.2. Diagnóza HCV/HIV koinfekce
18.8.3. Terapie HCV/HIV koinfekce
19. Sledování pacientů neléčených a pacientů s neúspěšnou léčbou
20. Vakcinace proti ostatním virovým infekcím jater
Použitá literatura
Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy C byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti ČLS JEP a Společnosti infekčního lékařství ČLS JEP. Jsou založena především na doporučeních vydaných Evropskou asociací pro studium jater (EASL) vydaných v září 2016. Doporučení definují preferovaný přístup k řešení problematiky HCV infekce. V oblasti léčby chronické HCV infekce je vždy zmíněno několik variant postupu. Tato skutečnost je dána rychlým vývojem nových protivirových preparátů a jejich nerovnoměrným zaváděním do rutinní praxe v jednotlivých zemích. Bezinterferonové režimy představují optimální léčebný postup pro každého pacienta s chronickou HCV infekcí. Po přechodné období jsou ve vybraných individuálních případech přijatelné léčebné režimy založené na podání pegylovaného interferonu-ɑ.
Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou C v celostátním měřítku. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
1. Epidemiologie HCV
Celosvětová prevalence infekce HCV se pohybuje v běžné populaci kolem 2-2,6 %. V roce 2001 bylo pomocí sérologického přehledu zjištěno, že prevalence protilátek anti-HCV v běžné populaci ČR je 0,2 %. Podle novějších údajů a modelování založeného na známých klinických údajích je za reálnou považována prevalence 0,4 %. HCV infekce je nejčastější příčinou jaterních onemocnění ve vyspělých zemích světa.
Infekce virem hepatitidy C patří mezi krví přenosné infekce. Hlavními cestami šíření HCV infekce jsou:
Od zahájení rutinního testování krevních dárců na přítomnost infekce HCV (v roce 1992) je hlavní cestou šíření infekce sdílení injekčního instrumentaria a věcí osobní potřeby (filtry, lžičky, kontejnery) při injekční aplikaci drog.
1.1. Prevence přenosu HCV
HCV pozitivní osoba musí být poučena, jak zabránit přenosu HCV na další osoby, zejména:
2. Přirozený průběh HCV infekce
Studie o přirozeném průběhu HCV infekce ukazují, že 55-85 % pacientů, kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat a infekce u nich tudíž přejde do chronického stadia. U 5-20 % osob z tohoto počtu dojde během 20-25 let k rozvoji jaterní cirhózy. Osoby s jaterní cirhózou při chronické HCV infekci mají riziko rozvoje end-stage-liver disease (cca 30 % během 10 let) a riziko vzniku hepatocelulárního karcinomu (HCC 1-2 % ročně). Faktory asociované s progresí jaterního postižení při chronické HCV infekci jsou:
Chronická HCV infekce je rovněž asociována s celou řadou tzv. extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinémie. Symptomatická smíšená kryoglobulinémie nebo jiná závažná forma extrahepatální manifestace HCV je indikací k protivirové léčbě bez ohledu na stupeň jaterního postižení.
3. Laboratorní vyšetřovací metody
3.1. Sérologické detekční metody
Jedná se sérologickou detekci anti-HCV protilátek. Protilátky jsou markerem expozice - kontaktu dané osoby s virem hepatitidy C. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organismu. Dlouhodobě, pravděpodobně doživotně, jsou prokazatelné i u pacientů úspěšně vyléčených. Technicky se jedná o detekci protilátek metodou EIA či některých jejích variant. V současné době se používají metody III. generace, které mají senzitivitu 97 % a specificitu až 99 %.
3.2. Molekulárně genetické metody
Molekulárně genetické metody prokazují přítomnost virové nukleové kyseliny (HCV RNA) v séru či tkáních infikovaného jedince. Největšího rozšíření v současné době dosáhla metoda polymerázové řetězové reakce v reálném čase (RT-PCR). Dostupná je kvalitativní varianta, většinou se však používá ve variantě kvantitativní. Koncentrace HCV RNA v biologických tekutinách se udává v IU/ml.
Kvantitativní stanovení HCV RNA v krvi by standardně mělo být prováděno metotodu s dolním limitem detekce ≤15 IU/ml. Protože řada laboratoří používá metody na stanovení HCV RNA, jejichž dolní limit detekce nedosahuje této hodnoty (je vyšší), je třeba, aby lékař zadávající vyšetření v souvislosti s hodnocením terapie dle těchto standardních postupů požadoval na laboratoři informaci, že citlivost jejich stanovení splňuje uvedený limit.
Součástí molekulárně biologického vyšetření by mělo být i stanovení genotypu a subtypu HCV. Genotypizace je důležitá z pohledu rozdílných léčebných postupů a rozdílné účinnosti léčby u jednotlivých genotypů HCV. Určení subtypu, zejména u genotypu 1, je významné pro určení rizika vzniku virologické rezistence v případě podání simepreviru (viz dále).
3.3. Genetické vyšetření infikované osoby
Stanovení genotypu IL28B infikované osoby ztratilo s nástupem režimů používajících vysoce účinná přímá antivirotika (DAA) svou prediktivní hodnotu.
4. Screening HCV infekce
Velká část osob infikovaných HCV v tuto chvíli vůbec neví, že by mohli být infikováni. Identifikace infikovaných osob je přitom jednou ze základních podmínek efektivní péče o toto onemocnění. V České republice nejsou k dispozici data, která by mohla odůvodnit uskutečnění populačního skríningu HCV infekce. Jednou z možností, jak efektivního skríningu dosáhnout, je plná informovanost lékařů primární péče (praktičtí lékaři, gynekologové, porodníci) a specialistů, kteří se podílejí na péči o pacienty ve vysoce rizikových skupinách.
Skríningovým vyšetřením HCV infekce je vyšetření anti-HCV protilátek. Reaktivita anti-HCV by měla být vyšetřena u všech osob, u kterých je podezření, že byly někdy v průběhu života exponovány některému z rizikových faktorů přenosu HCV. Na základě znalostí o možnostech přenosu je doporučováno testování HCV infekce zejména u těchto skupin osob:
Je-li vyšetřovaná osoba anti-HCV pozitivní, nelze očekávat vymizení anti-HCV protilátek ani po spontánní či léčbou navozené eliminaci viru, a proto není žádná indikace k opakování vyšetření anti-HCV kdykoliv v budoucnosti. Sérologická pozitivita anti-HCV protilátek pouze indikuje kontakt s HCV infekcí v minulosti a nekoreluje se žádnou z chrakteristik onemocnění (s pokročilostí jaterního postižení, s pravděpodobností dosažení vyléčení apod.). Každá anti-HCV pozitivní osoba musí být vyšetřena specialistou.
Mezi nově doporučované a akceptované metody skríningu patří užití tzv. rychlých diagnostických setů (RDT). Jedná se nově vyráběné diagnostické soupravy (kity), které detekují anti-HCV nejenom v plné krvi či plasmě, ale také v kapilární krvi odebrané z bříška prstu, nebo v orální (krevikulární) tekutině. Vyráběny jsou v různé podobě, svým provedením a jednoduchostí použití připomínají známější gravitesty. Vyšetření pomocí RDT nevyžaduje žádné zpracování odebrané tekutiny (centrifugaci apod.). Vyšetření může být provedeno při pokojové teplotě a nevyžaduje ani žádné speciální školení personálu, který s RDT pracuje. K datu vydání těchto doporučených postupů nemá žádný z RDT v České republice potřebná povolení k užití.
5. Diagnostická kritéria
5.1. Akutní HCV infekce
Akutní HCV infekce je diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu HCV infekce.
Spolehlivě lze stanovit diagnózu akutní HCV infekce pouze tehdy, je-li dokumentována sérokonverze na anti-HCV reaktivitu. Příčinou je skutečnost, že neexistuje sérologický marker akutní infekce HCV. O akutní HCV infekci lze také hovořit v případech, kdy jsou klinické příznaky v souladu s obrazem akutní hepatitidy. Jde především o tyto příznaky:
5.2. Chronická HCV infekce
Diagnóza chronické HCV infekce je založena na pozitivním průkazu sérové HCV RNA a anti-HCV protilátek v přítomnosti biochemických nebo histologických známek chronické hepatitidy (alternativou histologických změn je neinvazivní průkaz fibrózy jater). V případech akutní HCV infekce prakticky nedochází k eliminaci viru po více než 4-6 měsících od přenosu, proto může být pro definici chronické HCV infekce užit i tento časový parametr.
6. Vyšetření před zahájením protivirové léčby
Před zahájením protivirové léčby by měla být stanovena pokročilost jaterního onemocnění. Důvodem je především snaha identifikovat osoby s jaterní cirhózou či pokročilou (přemosťující) fibrózu, protože prognóza osob po protivirové léčbě je definována stadiem postižení jater před zahájením léčby. I pacienti s trvale normální aktivitou ALT mohou mít významnou fibrózu, i u těchto osob je proto indikováno vyšetření pokročilosti postižení. Znalost stádia jaterního poškození je rovněž důležitá pro načasování zahájení protivirové léčby. Tento moment se jeví v současné době rychlého rozvoje možností léčby jako velmi důležitý. Stejně tak před zahájením léčby musí být vyšetřeny vstupní virologické parametry, které mají vztah k volbě protivirové léčby.
6.1. Chronická HCV infekce
U každého pacienta s chronickou HCV infekcí by měla být provedena vyšetření, která umožňují odhalit jiná jaterní onemocnění nebo faktory ovlivňující vývoj HCV infekce. Jedná se zejména o
6.2. Stanovení pokročilosti jaterního postižení
Před protivirovou léčbou by měl být stanoven stupeň pokročilosti jaterního postižení, tj. stupeň jaterní fibrózy (stage). Zvláštní důležitost má identifikace pacientů s jaterní cirhózou nebo přemosťující fibrózou, protože jejich dlouhodobá prognóza po skončení léčby je dána právě tímto výchozím stupněm postižení. Pacient s jaterní cirhózou jsou i po úspěšné protivirové léčbě indikováni k doživotní dispenzarizaci a surveillanci HCC. Průkaz absence fibrózy je však také důležitý, a to především z pohledu urgence a načasování protivirové léčby s ohledem na rychle se měnící možnosti léčby. U pacientů s klinicky jasnou jaterní cirhózou není třeba verifikovat stupeň fibrózy. Normální hladiny ALT nevylučují přítomnost významné jaterní fibrózy.
Referenční metodou pro stanovení pokročilosti onemocnění byla po mnoho let jaterní biopsie. Umožňuje hodnocení zánětlivé aktivity (grading) i stupně fibrózy (staging). V současné době již nelze na základě mnoha publikovaných výsledků a studií indikovat jaterní biopsii pouze za účelem posouzení fibrózy jater a je nutno indikovat pouze provedení neinvazivního stanovení stupně jaterní fibrózy. Nejširšího uplatnění na tomto poli dosáhly metody měření tuhosti jater, které mají v případech chronické HCV infekce akceptovatelnou výpovědní hodnotu. Je nicméně třeba určité zkušenosti při jejich použití, existuje řada faktorů, které mohou jejich výsledky negativně ovlivnit, např. obezita.
Ke stanovení pokročilosti lze užít i některé tzv. krevní biomarkery jaterní fibrózy. Tato vyšetření jsou však spolehlivá pouze v diskriminaci jaterní cirhóza vs. non-cirhóza. K hodnocení jednotlivých stadií jaterní fibrózy se nehodí.
Kombinace vyšetření tuhosti jater a krevních biomarkerů jaterní fibrózy zvyšuje přesnost hodnocení pokročilosti jaterního procesu.
V případech, kdy jsou dostupná vyšetření stádia jaterní fibrózy rozporná, případně u osob, kdy existuje podezření na spoluúčast jiných faktorů než HCV infekce při progresi jaterní fibrózy (virová hepatitida B, metabolický syndrom, autoimunitní onemocnění, abusus alkoholu apod.) je i nadále indikace k provedení jaterní biopsie.
6.3. Virologické parametry
Před zahájením protivirové léčby by měly být vyšetřeny tyto parametry:
Tabulka 1: Klinicky významné substituce oblasti NS5A asociované s rezistencí
| Pozice aminokyseliny v oblasti NS5A | RAS Ledipasvir HCV GT 1a Léčba: sofosbuvir/ledipasvir |
RAS Elbasvir HCV GT 1a Léčba: grazoprevir/elbasvir |
NS5A RAS HCV GT 3 Léčba: sofosbuvir/velpatasvir |
| M28 | M28A | M28A | |
| M28G | M28G | ||
| M28T | M28T | ||
| Q30 | Q30E | Q30D | |
| Q30G | Q30E | ||
| Q30H | Q30G | ||
| Q30K | Q30H | ||
| Q30R | Q30K | ||
| Q30L | |||
| Q30R | |||
| L31 | L31M | L31F | |
| L31V | L31M | ||
| L31V | |||
| P32 | P32L | ||
| P32S | |||
| H58 | H58D | H58D | |
| Y93 | Y93C | Y93C | Y93H |
| Y93H | Y93H | ||
| Y93N | Y93N | ||
| Y93S | Y93S |
7. Indikace zahájení terapie: Kdo by měl být léčen?
Všichni pacienti s chronickou HCV infekcí, dosud protivirově neléčení, v minulosti léčení neúspěšně (tj. bez dosažení SVR), kteří léčeni chtějí být a nemají žádnou kontraindikaci léčby, jsou kandidáty protivirové terapie. Léčba by měla být bezodkladně poskytnuta pacientům s významnou fibrózou (METAVIR skóre F2 nebo F3) a s jaterní cirhózou (METAVIR F4), včetně dekompenzované cirhózy.
Další indikace k přednostnímu zahájení léčby jsou
Osoby s dekompenzovanou cirhózou a MELD skóre ≥18-20 bodů by měly nejdříve podstoupit transplantaci jater a teprve poté protivirovou léčbu, protože pravděpodobnost reparace jaterních funkcí a dlouhodobé přežití bez transplantace je velmi nízká.
Léčba není indikována u pacientů, jejichž krátkodobé a střednědobé přežití je limitováno závažným přidruženým onemocněním.
8. Kontraindikace zahájení terapie chronické HCV infekce
Podle dosavadních znalostí neexistují žádné absolutní kontraindikace podání jakéhokoliv přímo působícího virostatika registrovaného v EU k září 2016. Omezení podání jednotlivých kombinací u pacientů s určitým stupněm renální insuficience či konkomitantní medikací jsou součástí SPC každého preparátu a je povinností každého ošetřujícího lékaře se jimi řídit.
9. Cíle terapie chronické infekce virem hepatitidy C
Cílem terapie je vyléčení HCV infekce – trvalá eliminace viru. Eliminace viru brání rozvoji jaterních i mimojaterních komplikací HCV infekce, včetně pokročilé jaterní fibrózy, cirhózy, dekompenzované cirhózy a HCC. Eliminací infekce je myšleno dosažení setrvalé virologické odpovědi, která je definována jako negativní sérová HCV RNA ve 12. nebo 24. týdnu po skončení protivirové léčby. Podle odstupu vyšetření od konce léčby se někdy používá označení tzv. SVR12 a SVR24. SVR12 a SVR24 spolu korelují v 99 % případů. Podle dlouhodobých studií SVR v 99 % případů znamená trvalé vyléčení HCV infekce, tj. u osob se SVR nedochází k pozdním relapsům onemocnění.
U osob se SVR dochází k významnému snížení jaterní morbidity i mortality. Pacienti s jaterní cirhózou, u nichž bylo dosaženo eradikace HCV infekce, mají významně snížené riziko dekompenzace cirhózy a HCC. Minimální riziko rozvoje HCC však trvá, proto je u těchto osob indikována standardní surveillance HCC.
U populace ve vysokém riziku přenosu HCV infekce se může objevit reinfekce. Tato je definována jako znovuobjevení sérové HCV RNA minimálně 6 měsíců po dosažení SVR. K přesnému stanovení diagnózy reinfekce by měla být prokázána infekce jiným genotypem či alespoň fylogeneticky vzdáleným řetězcem proti primoinfekci.
10. Dostupná protivirová léčba
10.1. Sofosbuvir
Sofosbuvir (SOF, nukleotidový NS5B inhibitor) je syntetický inhibitor (analog uridinu) virové RNA dependentní RNA polymerázy (RdRp, produkt NS5B oblasti virové genomu). Sofosbuvir je prodrug, který je intracelulárně trifosforylován, a následně je pomocí RdRp inkorporován do HCV RNA. Mechanismem účinku je tzv. ukončení řetězce, kdy po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. SOF je účinný u všech hlavních nejrozšířenějších genotypů HCV (1-6), neinterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy.
SOF není metabolizován systémem cytochromu, potenciál lékových interakcí je tedy mnohem omezenější, nežli u virostatik nižších generací. SOF je substrátem lékového transportéru P-gp a „breast cancer resistance protein“ (BCRP), jeho aktivní metabolit však nikoliv. Potentní induktory P-gp ve střevě (rifampicin, karbamazepin a fenytoin) snižují plasmatickou hladinu SOF, snižuje se tedy i intracelulární přítomnost aktivního metabolitu a dochází ke snížení protivirové účinnosti SOF. Naopak inhibitory P-gp/BCRP zvyšují plasmatickou hladinu SOF avšak nikoliv aktivního metabolitu, takže SOF může být s inhibitory podáván současně. SOF v kombinaci s jinými DAA je kontraindikován u pacientů léčených amiodaronem pro riziko maligních arytmií.
SOF je vyráběn ve formě potahované tablety obsahující 400 mg účinné látky. Celková denní dávka je 400 mg, tj. 1 tbl denně. Dostupný lék: Sovaldi, výrobce Gilead Sciences, USA.
10.2. Fixní kombinace sofosbuviru a ledipasviru
Tato kombinace je dostupná ve formě jedné tablety obsahující 400 mg sofosbuviru a 90 mg ledipasviru (LDV). Celková denní dávka je 1 tbl denně.
Ledipasvir je NS5A inhibitorem a je transportován podobně jako sofosbuvir, tj. na jeho transportu se účastní P-gp a „breast cancer resistance protein“ (BCRP). Lékové interakce jsou proto velmi podobné. Ledipasvir je v nezměněné podobě vylučován žlučí, ledvinami je vyloučeno pouze 1 % celkového množství. V případě fixní kombinace sofosbuviru a ledipasviru není třeba redukce dávky u pacientů s mírnou či středně závažnou renální insuficiencí. Bezpečnost podání nebyla dosud zkoumána u pacientů s poklesem eGFR <30 ml/min/1,73 m2 a u pacientů se selháním ledvin vyžadujícím hemodialýzu.
Dostupný lék: Harvoni, výrobce Gilead Sciences, USA.
10.3. Fixní kombinace sofosbuviru a velpatasviru
Fixní kombinace sofosbuviru a velpatasviru je dostupná ve formě jedné tablety obsahující 400 mg sofosuviru a 100 mg velpatasviru.
Velpatasvir (VEL, NS5A inhibitor) je inhibitorem lékového transportéru P-gp a BCRP a transportních molekul v bazolaterální membráně hepatocytu (OATP) 1B1 a OATP1B3. Velpatasvir je substrátem CYP2B6, CYP2C8 a CYP3A4 s pomalým metabolismem. Po jedné dávce 100 mg velpatasviru značeného izotopem 14C byla většina aktivity (> 98 %) v plasmě tvořena nezměněnou mateřskou látkou. Nezměněný velpatasvir je také hlavní složkou přítomnou ve stolici.
Současné podávání kombinace SOF/VEL s léčivými přípravky, které jsou substráty výše zmíněných transportérů, může zvýšit expozici (a toxické účinky) takových léčivých přípravků. Nositelem většiny lékových interakcí je VEL, potenciál lékových interakcí SOF je minimální. Z praktického hlediska je třeba upozornit na tyto problematické lékové skupiny či léčiva:
Léčivé přípravky, které jsou středně silnými induktory střevního P-gp (např. oxcarbazepin, modafinil nebo efavirenz), mohou snižovat koncentraci sofosbuviru nebo velpatasviru v plazmě a vést k poklesu terapeutického účinku jejich kombinace. Současné podávání takových léčivých přípravků se SOF/VEL se nedoporučuje. Současné podávání s léčivými přípravky, které inhibují P-gp nebo BCRP, může zvýšit plazmatické koncentrace sofosbuviru nebo velpatasviru. Léčivé přípravky, které inhibují OATP, CYP2B6, CYP2C8 nebo CYP3A4, mohou zvyšovat plazmatické koncentrace velpatasviru. Klinicky významné interakce léčivých přípravků s kombinací SOF/VEL zprostředkované inhibitory P-gp, BCRP, OATP nebo CYP450 se nepředpokládají.
Dostupný lék: Epclusa, výrobce Gilead Sciences, USA.
10.4. Dasabuvir, ombitasvir, paritaprevir/ritonavir (kombinace 3D)
Dasabuvir (nenukleosiový NS5B inhibitor) je nenukleosidovým inhibitorem RdRp, produktu NS5B virového genomu. Není určen k podávání v monoterapi, striktně je třeba jej kombinovat s ombitasvirem/paritaprevirem/ritonavirem (viz dále). Kombinací dochází ke spojení tři přímo působící antivirotik s různými mechanismy účinku a nepřekrývajícími se profily rezistence vůči cílovému HCV.
Dasabuvir je metabolizován systémem cytochromu, především pomocí CYP2C8 a CYP3A. Proto se při kombinaci dasabuviru s induktory těchto systémů očekává snížení jeho plazmatické koncentrace a snížení jeho protivirového účinku. Níže jsou uvedeny příklady induktorů, které jsou považovány z tohoto důvodu za kontraindikované k současnému podání s dasabuvirem. Naopak podání silných inhibitorů CYP2C8 může vést ke vzestupu plazmatické koncentrace dasabuviru a v důsledku toho ke zvýšení množství a závažnosti možných nežádoucích účinků.
Ombitasvir je inhibitorem NS5A proteázy, paritaprevir je inhibitorem NS3/4 proteázy viru. Ombitasvir i paritaprevir jsou metabolizovány přes složky cytochromu CYP3A. Další součást kombinace, ritonavir, není látkou s protivirovou účinností proti HCV. Je silným inhibitorem CYP3A. Jeho zařazení do 3D kombinace umožnilo snížení použité dávky paritapreviru. Při současném zachování optimální protivirové účinnosti paritapreviru tak došlo ke snížení počtu a závažnosti nežádoucích účinků.
Dostupné léky: Exviera (výrobce AbbVie, USA) potahovaná tableta obsahující dasabuvir 250 mg. Viekirax (AbbVie, USA) obsahuje v potahované tabletě ombitasvir 12,5 mg, paritaprevir 75 mg a ritonavir 50 mg.
10.5. Grazoprevir a elbasvir
Grazoprevir (GZR, inhibitor NS3/4A proteázy) a elbasvir (EBR, inhibitor NS5A druhé generace) jsou dostupné ve fixní kombinaci v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Doporučené dávkování je 1 tbl denně.
GZR i EBR jsou částečně metabolizovány CYP3A4, avšak metabolity nelze prokázat v plazmě. Eliminace metabolitů probíhá žlučí a stolicí. GZR je substrátem P-gp a OATP1B1, EBR je substrátem P-gp. V plasmě jsou obě látky vázány na bílkoviny a jejich poločas je 24 a 31 hodin. Farmakokinetický profil obou látek je determinován funkční schopností jaterní tkáně, proto je kombinace GZR/EBR kontraindikována u pacientů s jaterní cirhózou funkční klasifikace Child-Pugh B a C. U pacientů s renální insuficiencí všech stupňů, včetně pacientů v pravidelném dialyzačním léčení (PDL) není třeba redukovat dávku. Vzhledem k výše zmíněnému vztahu k CYP3A mohou induktory těchto proteinů (karbamazepin, bosentan, modafinil, fenytoin, efavirenz, etravirin atd.) snižovat jejich plazmatické hladiny, a proto je jejich současné podání považováno za kontraindikované. Podání inhibitorů CYP3A naopak zvyšuje jejich plazmatické hladiny a proto jsou rovněž kontraindikovány cyklosporin, rifampicin). Při podání dalších farmak interferujících s CYP3A je třeba opatrnosti, jde např. o takrolimus, některé statiny, dabigatran).
Dostupný lék: Zepatier, výrobce Merck, USA.
10.6. Daclatasvir
Daclatasvir (DCV) je inhibitor replikačního komplexu NS5A. Blokuje dvě fáze virového replikačního cyklu, a to sice syntézu RNA, ale také kompletaci virionu a pravděpodobně i proces jeho uvolnění z hepatocytu. Daclatasvir je metabolizován pomocí CYP34A, je inhibitorem P-gp. Má proto rovněž potenciál lékových interakcí. Daclatasvir je vyráběn ve formě tablety obsahující 60 mg účinné látky. Celková denní dávka je 60 mg, tj. 1 tableta denně.
Dostupný lék: Daklinza, výrobce BristolMyers-Squibb, USA.
10.7. Simeprevir
Simeprevir (SMV) je specifický inhibitor virové NS3/4A serinové proteázy. Někdy bývá označován jako virostatikum „druhé vlny první generace“ DAA. SMV je transformován pomoci systému CYP3A4, a proto může jeho podání podléhat interakcím s inhibitory či induktory tohoto systému. Inhibitory CYP3A4 hladinu SMV zvyšují, hrozí proto vzrůst jeho sérové hladiny, které vede k vyššímu výskytu závažnějších NÚ. Podání induktorů CYP3A4 naopak zvyšuje odbourávání SMV, plasmatické hladiny klesají a důsledkem je ztráta protivirové účinnosti. Z důvodu tohoto potenciálu lékových interakcí je proto potřeba v rizikových případech zkontrolovat podávanou medikaci se seznamem kontraindikovaných a rizikových látek, který je součástí SPC SMV. SMV je vyráběn ve formě tobolky obsahující 150 mg účinné látky. Celková denní dávka je 150 mg, tj. 1 tobolka denně.
Dostupný lék: Olysio, výrobce Janssen-Cilag, Belgie.
10.8. Ribavirin
Dávka ribavirinu (RBV) by měla být závislá na tělesné hmotnosti: 1000 mg při hmotnosti <75 kg a 1200 mg při hmotnosti ≥75 kg a měla by být rozdělena do dvou dávek.
11. Terapie HCV infekce
V současné době je pro pacienty s chronickou HCV infekcí dostupná celá řada léčebných kombinací, ze kterých budou mít užitek jak pacienti dosud neléčení, tak osoby s neúspěšnou léčbou v minulosti. Indikace a podání jednotlivých léčebných variant je závislé na genotypu HCV, případně i subtypu HCV a na stupni pokročilosti jaterního postižení. Indikace jsou stejné pro HCV monoinfikované pacienty i pro pacienty s HCV/HIV koinfekcí.
Tabulka 2 ukazuje bezinterferonové režimy vhodné pro jednotlivé genotypy HCV. Jednotlivé konkrétní možnosti léčby pro každý genotyp jsou rozebrány níže.
Tabulka 2: Dostupné varianty bezinterferonových režimů pro jednotlivé genotypy HCV
| kombinace | genotypy HCV | ||||
| GT 1 | GT 2 | GT 3 | GT 4 | GT 5 a 6 | |
| sofosbuvir/ledipasivir ± ribavirin | ano | ne | ne | ano | ano |
| sofosbuvir/velpatasvir ± ribavirin | ano | ano | ano | ano | ano |
| ombitasvir/paritaprevir/(r) + dasabuvir ± ribavirin * | ano | ne | ne | ne | ne |
| ombitasvir/paritaprevir/(r) ± ribavirin * | ne | ne | ne | ano | ne |
| grazoprevir/elbasvir ± ribavirin | ano | ne | ne | ano | ne |
| sofosbuvir + daclatasvir ± ribavirin | ano | ano | ano | ano | |
| sofosbuvir + simeprevir ± ribavirin | suboptimální | ne | ne | ano | ne |
Tabulka 3: Doporučené režimy léčby chronické HCV infekce a koinfekce HCV/HIV u pacientů bez jaterní cirhózy, pacienty dosud neléčené a pacienty s neúspěšnou léčbou PEG-IFN + RBV
| Genotyp | Léčebně naivní (TN) nebo opakovaně léčení (TE) | SOF/LDV | SOF/VEL | 3D | 2D | GZR/EBR | SOF+DCV | SOF+SMV |
| GT 1a | TN | 8–12 týd. bez RBV | 12 týd. bez RBV | 12 týd. s RBV | ne | 12 týd. bez RBV při HCV RNA ≤800 tis. IU/ml nebo 16 týd. s RBV při HCV RNA >800 tis. IU/ml** | 12 týd. bez RBV | ne |
| TE | 12 týd. bez RBV | 12 týd. s RBV* nebo 24 týd. bez RBV | ||||||
| GT 1b | TN | 8-12 týd. bez RBV | 12 týd. bez RBV | 8-12 týd. bez RBV | ne | 12 týd. bez RBV | 12 týd. bez RBV | ne |
| TE | 12 týd. bez RBV | 12 týd. bez RBV | ||||||
| GT 2 | všichni | ne | 12 týd. bez RBV | ne | ne | ne | 12 týd. bez RBV | ne |
| GT 3 | TN | ne | 12 týd. bez RBV | ne | ne | ne | 12 týd. bez RBV | ne |
| TE | 12 týd. s RBV | 12 týd. s RBV*** nebo 24 týd. bez RBV | ||||||
| GT 4 | TN | 12 týd. bez RBV | 12 týd. bez RBV | ne | 12 týd. s RBV | 12 týd. bez RBV | 12 týd. bez RBV | 12 týd. bez RBV |
| TE | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. bez RBV při HCV RNA ≤800 tis. IU/ml nebo 16 týd. s RBV při HCV RNA >800 tis. IU/ml** | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. s RBV nebo 24 týd. bez RBV | ||||
| GT 5/6 | TN | 12 týd. bez RBV | 12 týd. bez RBV | ne | ne | ne | 12 týd. bez RBV | ne |
| TE | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. s RBV nebo 24 týd. bez RBV |
TE – opakovaně léčení pacienti, TN – dosud neléčení pacienti
* přidat RBV pouze v případech detekce RAS pokud je dostupné spolehlivé testování, blíže viz kapitola 11.1.1.
** prodloužit na 16 týdnů a přidat RBV pouze u pacientů s RAS pro elbasvir před zahájením léčby, je-li testování dostupné
*** doplnit RBV pouze u pacientů s výchozími NS5A RAS Y93H pokud je testování dostupné
Tabulka 4: Doporučené režimy léčby chronické HCV infekce a koinfekce HCV/HIV u pacientů s kompenzovanou jaterní cirhózou (Child-Pugh A), včetně pacientů dosud neléčených a pacienty s neúspěšnou léčbou PEG-IFN + RBV
| Genotyp | Léčebně naivní (TN) nebo opakovaně léčení (TE) | SOF/LDV | SOF/VEL | 3D | 2D | GZR/EBR | SOF+DCV | SOF+SMV |
| GT 1a | TN | 12 týd. bez RBV | 12 týd. bez RBV | 24 týd. s RBV | ne | 12 týd. bez RBV při HCV RNA ≤800 tis. IU/ml nebo 16 týd. s RBV při HCV RNA >800 tis. IU/ml** | 12 týd. bez RBV | ne |
| TE | 12 týd. bez RBV | 12 týd. s RBV* nebo 24 týd. bez RBV | ||||||
| GT 1b | TN | 12 týd. s RBV | 12 týd. bez RBV | 12 týd. bez RBV | ne | 12 týd. bez RBV | 12 týd. bez RBV | ne |
| TE | ||||||||
| GT 2 | všichni | ne | 12 týd. bez RBV | ne | ne | ne | 12 týd. bez RBV | ne |
| GT 3 | TN | ne | 12 týd. s RBV*** nebo 12 týd. bez RBV | ne | ne | ne | 24 týd. bez RBV | ne |
| TE | ||||||||
| GT 4 | TN | 12 týd. bez RBV | 12 týd. bez RBV | ne | 12 týd. s RBV | 12 týd. bez RBV | 12 týd. bez RBV | 12 týd. bez RBV |
| TE | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. bez RBV při HCV RNA ≤800 tis IU/ml nebo 16 týd. s RBV při HCV RNA >800 tis. IU/ml** | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. s RBV nebo 24 týd. bez RBV | ||||
| GT 5/6 | TN | 12 týd. bez RBV | 12 týd. bez RBV | ne | ne | ne | 12 týd. bez RBV | ne |
| TE | 12 týd. s RBV nebo 24 týd. bez RBV | 12 týd. s RBV nebo 24 týd. bez RBV |
TE – opakovaně léčení pacienti, TN – dosud neléčení pacienti
* přidat RBV pouze v případech detekce RAS pokud je dostupné spolehlivé testování, blíže viz kapitola 11.1.1.
** prodloužit na 16 týdnů a přidat RBV pouze u pacientů s RAS pro elbasvir před zahájením léčby, je-li testování dostupné
*** doplnit RBV pouze u pacientů s výchozími NS5A RAS Y93H pokud je testování dostupné
11.1. Genotyp HCV 1
11.1.1. Léčebná varianta 1: sofosbuvir/ledipasvir
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
Uvedená kombinace byla zkoumána v rozsáhlém programu fáze III. Ve studii ION-1 (dosud neléčené osoby, 16 % pacientů s kompenzovanou jaterní cirhózou) byla SVR12 99 % ve skupině pacientů bez RBV a 97 % (NS) ve skupině s RBV. Léčba byla stejně účinná při délce podávání 12 a 24 týdnů. Ve studii ION-3 mezi dosud neléčenými pacienty bez cirhózy byla SVR12 94 % bez RBV při délce podávání 8 týdnů, 93 % s RBV při stejné délce léčby. Při léčbě bez RBV po dobu 12 týdnů byla SVR12 95 %. V ramenech s 8týdenní léčbou bylo však zaznamenáno větší množství relapsů. Bližší pozdější analýzy ukázaly, že faktorem negativně determinujícím efekt léčby trvající 8 týdnů byla virémie <6 milionů IU/ml. Data však ani v tuto chvíli nelze hodnotit jako definitivní a je třeba vyčkat ověření, že tato kombinace podávaná u dosud neléčených osob po dobu 8 týdnů je dostatečně efektivní.
Studie ION-2 zkoumala účinek této kombinace u pacientů v minulosti neúspěšně léčených. Zahrnuti byli pacienti léčení kombinací PEG-IFN + RBV, ale i PEG-IFN + RBV + boceprevir nebo telaprevir. 20 % pacientů mělo jaterní cirhózu. SVR12 byla ve skupině s kombinací s RBV 94 %, bez RBV 96 %. Po 24 týdnech byla SVR12 v obou případech 99 %. Ve studii SIRIUS byla zkoumána účinnost SOF/LDV s RBV po dobu 12 týdnů vs. SOF/LDV bez RBV po dobu 24 týdnů u pacientů s kompenzovanou jaterní cirhózou, kteří byli neúspěšně léčení kombinací PEG-IFN + RBV + boceprevir nebo telaprevir. SVR12 byla 96 % a 97 %.
Sebraná data 1566 pacientů, kteří byli léčeni aktuálně doporučovanými režimy SOF/LDV ve studiích fází II a III, ukázala, že přítomnost NS5A RAS v okamžiku zahájení léčby neměla vliv na SVR12 u léčebně naivních osob, bez ohledu na přítomnost či absenci cirhózy. SVR12 byla dosažena u 99 % léčebně naivních pacientů bez cirhózy v obou případech (s RAS a bez RAS), u cirhotiků bylo vždy dosaženo SVR12 v 96 % případů. RAS s ledipasvirem přítomné před zahájením léčby nicméně snížily SVR12 u opakovaně léčených osob bez cirhózy léčených 12 týdnů bez RBV: 90 % ve skupině s RAS a 99 % bez RAS. Podobného efektu bylo dosaženo i u genotypu HCV 1a. Přidání RBV tento negativní efekt bazálních RAS prevenuje.
11.1.2. Léčebná varianta 2: sofosbuvir/velpatasvir
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.1.3. Léčebná varianta 3: ombitasvir + paritaprevir/ritonavir + dasabuvir (3D)
Tato léčebná kombinace se skládá z ombitasviru 12,5 mg, paritapreviru 75 mg a ritonaviru 50 mg v jedné tabletě (dávkování: 2 tbl 1x denně spolu s jídlem) a dasabuviru 250 mg (dávkování: 1 tbl 2x denně). Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
Studie SAPHIRE-I zkoumala SVR u pacientů dosud neléčených bez jaterní cirhózy. Léčeni byli kombinací 3D s ribavirinem po dobu 12 týdnů a SVR12 byla 95 % u genotypu 1a a 98 % u genotypu 1b. Ve studii PEARL-IV byla SVR12 bez RBV 90 % a 97 % s RBV. Ve studii PEARL-III u pacientů dosud neléčených bez jaterní cirhózy infikovaných genotypem 1 b byla SVR12 bez RBV 99 % a s RBV rovněž 99 % . Ve studii TURQUOISE-1 u dosud neléčených osob bez jaterní cirhózy koinfikovaných HIV a stabilizovaných na režimech s atazanavirem nebo raltegavirem byla SVR12 po 12 týdnech 93 %, po 24 týdnech 91 %. U osob infikovaných genotypem 1a byla SVR12 91 % a u infekcí genotypem 1b byla SVR12 100 %.
U osob bez jaterní cirhózy v minulosti neúspěšně léčených PEG-IFN a RBV léčených kombinací 3D s RBV ve studii SAPHIRE-II byla SVR12 u genotypu 1a 96 % a u genotypu 1b 97 %. Souhrnně u relapsérů byla SVR12 95 %, 100 % u pacientů s částečnou odpovědí a 95 % u předchozích null-responderů. Ve studii PEARL-II byla SVR12 100 % u osob infikovaných genotypem 1b a léčených 3D bez RBV a 97 % u osob léčených 3D s RBV. U dosud neléčených osob a osob v minulosti neúspěšně léčených s kompenzovanou cirhózou byla SVR12 92 % po 12 týdenní léčbě a 96 % po 24týdenní léčbě s ribavirinem (studie TURQUOISE-II). U osob infikovaných genotypem 1a byla SVR12 92 % a u genotypu 1b byla SVR12 99 %. U osob s hladinou AFP <20 ng/ml, počtem trombocytů ≥90x109/l a koncentrací albuminu ≥35 g/l byl počet relapsů 1 % po 12 týdnech a 0 % po 24 týdnech léčby. U pokročilejších pacientů s hodnotami AFP >20 ng/ml, počtem trombocytů <90x109/l a koncentrací albuminu <35 g/l byl počet relapsů 21 % po 12 týdenní léčbě a 2 % po 24 týdenní léčbě.
11.1.4. Léčebná varianta 4: grazoprevir/elbasvir
Kombinace GZR/EBR je dostupná jako fixní kombinace v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
Studie C-EDGE-TN zahrnovala léčebně naivní pacienty infikovaní genotypem HCV 1a nebo 1b, kteří byli léčeni kombinací GZR/EBR po dobu 12 týdnů bez RBV. SVR12 byla u GT 1a 92 % a 99 % u GT 1b. Výsledek nebyl ovlivněn přítomností jaterní cirhózy. Studie C-EDGE-COINFECTION měla za cílovou populaci HCV/HIV koinfikované osoby s cirhózou nebo bez ní. Léčba probíhala 12 týdnů. SVR12 u HCV GT 1a byla 97 % a 95 % u GT 1b. SVR12 ve vztahu k virémii a přítomnosti významných RAS (tabulka 1) ukazuje tabulka 5.
Tabulka 5: SVR12 u léčebně naivních osob při kombinaci GZR/EBR ve vztahu k RAS a virémii u HCV GT 1a
| HCV GT 1a, naivní, 12 týdnů bez RBV | SVR12 |
| HCV RNA ≤800 000 IU/ml a RAS nepřítomny | 99 % |
| HCV RNA ≤800 000 IU/ml a RAS přítomny | 100 % |
| HCV RNA >800 000 IU/ml a RAS nepřítomny | 97 % |
| HCV RNA >800 000 IU/ml a RAS přítomny | 52 % |
Opakovaně léčené osoby byly cílovou populací studie C-EDGE-TE, léčebný režim byl GZR/EBR bez RBV po dobu 12 týdnů a SVR12 u HCV GT 1a byla 92 %, u HCV GT 1b 100 %. Stejný režim s RBV měl SVR12 u GT 1a 93 % a GT 1b 97 %. Šestnáctitýdenní podávání kombinace bez RBV vedlo k SVR12 u GT 1a ve 94 %, u GT 1b ve 98 % případů. Při podání 16 týdnů s RBV byla u obou GT SVR12 100 %.
Tabulka 6: SVR12 u opakovaně léčených osob při kombinaci GZR/EBR ve vztahu k RAS a virémii u HCV GT 1a
| HCV GT 1a, naivní, 12 týdnů bez RBV | SVR12 |
| HCV RNA ≤800 000 IU/ml a RAS nepřítomny* | 100 % |
| HCV RNA >800 000 IU/ml a RAS nepřítomny | 97 % |
| HCV RNA >800 000 IU/ml a RAS přítomny | 29 % |
* žádný pacient ve studiích fáze II a III neměl při HCV RNA ≤800 000 IU/ml prokázanou přítomnost RAS pro elbasvir
11.1.5. Léčebná varianta 5: sofosbuvir + daclatasvir
Pacienti infikovaní HCV GT 1 mohou být léčeni kombinací sofosbuviru (SOF) 400 mg denně a daclatasviru (DCV) 60 mg denně. Dávka DCV musí být redukována na 30 mg u HIV/HCV koinfikovaných pacientů léčených ritonavirem nebo atazanavirem/cobicistatem nebo elvitegravirem/cobicistatem a zvýšena na 90 mg u HIV/HCV koinfekce léčené efavirenzem.
Další indikace a režimy (tabulka 3 a tabulka 4):
11.2. Genotyp HCV 2
11.2.1. Léčebná varianta 1: sofosbuvir + velpatasvir
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.2.2. Léčebná varianta 2: sofosbuvir + daclatasvir
Pacienti infikovaní HCV GT 2 mohou být léčeni kombinací sofosbuviru (SOF) 400 mg denně a daclatasviru (DCV) 60 mg denně.
Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.3. Genotyp HCV 3
11.3.1. Léčebná varianta 1: sofosbuvir/velpatasvir
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.3.2. Léčebná varianta 2: sofosbuvir + daclatasvir
Sofosbuvir je podáván v dávce 400 mg denně, daclatasvir 60 mg denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4. Genotyp HCV 4
11.4.1. Léčebná varianta 1: sofosbuvir/ledipasvir
Kombinace SOF/LDV je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a LDV 90 mg. Standardní dávkování je 1 tableta denně.
Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4.2. Léčebná varianta 2: sofosbuvir/velpatasvir
Kombinace SOF/VEL je dostupná jako fixní kombinace v jedné tabletě obsahující SOF 400 mg a VEL 100 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4.3. Léčebná varianta 3: ombitasvir + paritaprevir/ritonavir (2D)
Pacienti infikovaní genotypem HCV 4 mohou být léčeni kombinací ombitasviru (12,5 mg), paritapreviru (75 mg) a ritonaviru (50 mg) v jedné tabletě (celková denní dávka je 2 tbl denně). Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4.4. Léčebná varianta 4: grazoprevir/elbasvir
Kombinace GZR/EBR je dostupná jako fixní kombinace v jedné tabletě obsahující GZR 100 mg a EBR 50 mg. Standardní dávkování je 1 tableta denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4.5. Léčebná varianta 5: sofosbuvir + daclatasvir
Sofosbuvir je podáván v dávce 400 mg denně, daclatasvir 60 mg denně. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.4.6. Léčebná varianta 6: sofosbuvir + simeprevir
Dávkování: sofosbuvir 400 mg denně a simeprevir 150 mg denně po dobu 12 týdnů. Konkrétní použití této kombinace je následující (viz tabulka 3 a tabulka 4):
11.5. Genotypy HCV 5 a 6
Tyto genotypy se v České republice prakticky nevyskytují, léčebné varianty proto nebudou rozebírány. V případě nutnosti lze všechny léčebné možnosti nalézt v textu standardních doporučení vydaných Evropskou asociací pro studium jater na stránce www.easl.eu.
12. Monitorování léčby HCV infekce
12.1. Monitorování účinnosti léčby
Monitorování účinnosti léčby je založeno na opakovaném sledování sérových koncentrací HCV RNA. K tomuto účelu je třeba užívat metody o standardní citlivosti <15 IU/ml. Nutné je dbát na to, aby při sledování jednoho konkrétního pacienta byla využívána stejná metoda, ideálně stejná laboratoř. Pro účely monitorování účinnosti léčby a pro kvalifikované rozhodování o pokračování či naopak o ukončení protivirové léčby je třeba respektovat definované časové body, kdy je vyšetření HCV RNA indikováno. Časové body, kdy je vhodné vyšetření HCV RNA, se můžou u jednotlivých léčebných variant lišit.
Obecně jde především o tyto indikace:
12.2. Monitorování bezpečnosti léčby
Dosud nebyly definovány vhodné intervaly klinických kontrol z pohledu monitorování možných nežádoucích účinků léčby. Tyto je třeba individualizovat s ohledem na dostupná data o výskytu možných vážnějších nežádoucích reakcí, které jsou však u bezinterferonových léčebných režimů velmi vzácné.
Pacienti léčení protivirovými režimy se sofosbuvirem by měli mít pravidelně kontrolovány renální funkce. Simeprevir může být příčinou zvýšení hladiny nepřímého bilirubinu a kožních reakcí. 3D kombinace rovněž může vést ke vzestupu hladiny nepřímého bilirubinu, během prvních 4 týdnů dochází často k asymptomatické elevaci ALT. Tato nekoreluje výskytem ani časově s hyperbilirubinémií. Vážné vedlejší reakce (SAE) byly popsány v rámci klinických studií u cca 2,5 % pacientů léčených kombinací GZR/EBR ± RBV. Kromě s placebem srovnatelných reakcí typu cefalea, únava, dyspepsie se vyskytly kolem 10. týdne léčby asymptomatické elevace ALT do pětinásobku normy. Spontánně odezněly při pokračování léčby nebo nejpozději po jejím ukončení.
12.3. Monitorování lékových interací během léčby HCV infekce
Dostupné nové protivirové léky často přinášejí množství lékových interakcí. Proto je třeba před a během podávaní nových léčebných režimů opakovaně monitorvat současně podávanou medikaci. V nutných případech je nutné konkomitantní léčbu přerušit (pokud lze) nebo zvolit alternativu s menším rizikem interakcí.
13. Metody zvýšení adherence pacientů k léčbě
Plná adherence ke všem podávaným a výše diskutovaným preparátům je základní podmínkou dosažení vysoké úspěšnosti léčby, tj. vysoké SVR. Není-li tato podmínka splněna, je vysoké riziko selhání léčby, ať už ve formě breakthrough fenoménu či relapsu HCV po skončení protivirové léčby, v případě podání DAA se dále zvyšuje také riziko vzniku virologické rezistence. Existuje několik základních opatření, jak adherenci zvýšit:
14. Péče o pacienty s dosaženou SVR
Pacienti bez jaterní cirhózy, kteří dosáhli SVR, by měli být znovu testováni ve 48. týdnu po skončení léčby. Pokud je v tomto okamžiku sérová HCV RNA nedetekovatelná, je možno považovat HCV infekci za vyléčenou v daném případě a HCV RNA již dále nemusí být vyšetřována. Pacienti se SVR, u nichž ale byly před zahájením protivirové léčby přítomny ještě jiné možné příčiny jaterního onemocnění (diabetes mellitus, zvýšený příjem alkoholu), by měli být dále sledováni v odborných poradnách. Interval sledování nebyl stanoven.
Pacienti s jaterní cirhózou a pacienti s přemosťující fibrózou (METAVIR F3), kteří dosáhnou SVR, by měli být zařazeni do programů surveillance HCC a měla by být u nich monitorována možná progrese portální hypertenze. U této skupiny nemocných je proto indikována abdominální sonografie v intervalu 6 měsíců, a pokud byly přítomny jícnové varixy před zahájením léčby, je třeba provádět endoskopické vyšetření v intervalu 1 roku. Další faktory, diabetes mellitus typu 2 či anamnéza abusu alkoholu může tento navrhovaný postup modifikovat.
U osob s vysokým rizikem infekce, jako jsou např. intravenózní uživatelé drog či homosexuálové, je třeba uvažovat i o riziku reinfekce. Riziko reinfekce je nicméně malé, publikovaná data se pohybují v rozmezí 1 až 8 % ročně.
15. Léčba pacientů s hepatocelulárním karcinomem bez indikace k transplantaci jater
Protivirová léčba je indikována pouze v případě, že u pacienta lze použít některou potenciálně kurativní metodu léčby HCC. V takovém případě se pravidla léčby této skupiny pacientů nijak neliší od pravidel probraných v předchozích kapitolách.
16. Léčba pacientů s pokročilým jaterním onemocněním
16.1. Kompenzovaná jaterní cirhóza
Pacienti s kompenzovanou jaterní cirhózou představují skupinu osob, u kterých by měla být protivirová léčba zahájena co nejdříve. Všechny komplikace jaterní cirhózy, dekompenzace, rozvoj HCC, se v této skupině mohou objevit v krátkém časovém horizontu. Snížení incidence dekompenzace a HCC v případech úspěšné léčby bylo prokázáno opakovaně metaanalýzami. Tito pokročilí pacienti rovněž vyžadují zvláštní péči ve smyslu prevence a včasné léčby závažných nebo potenciálně závažných nežádoucích účinků léčby. Jde většinou o pacienty, kteří jsou ve srovnání s pacienty bez cirhózy starší, mající řadu souběžné medikace, a tudíž také léčbu hůře snášejí. Tito pacienti by měli být v současné době léčeni pouze režimy bez interferonu a ideálně i bez ribavirinu, abychom dosáhli maximální možné účinnosti a předešli závažným nežádoucím účinkům, které by mohly vést k předčasnému ukončení terapie.
16.2. Pacienti indikovaní k transplantaci jater
Transplantace jater (Tx) je postupem volby u pacientů s konečným stadiem jaterního onemocnění. Rekurence HCV infekce s reinfekcí štěpu po Tx je prakticky 100 %, životnost štěpu je také u pacientů s rekurentní HCV infekcí zkrácena. U pacientů čekajících na Tx jater je protivirová léčba jednoznačně indikována, protože v případech, kdy je HCV RNA nedetekovatelná alespoň 30 dnů před vlastní Tx, nedochází k rekurenci infekce po Tx jater.
Pro pacienty před Tx jater platí následující doporučení:
1. Pacienti s jaterní cirhózou, funkční klasifikace Child-Pugh A, u nichž je indikací k Tx průkaz HCC, mají být léčeni dle standardních doporučení pro pacienty s kompenzovanou cirhózou. Podávání protivirové léčby by však nemělo oddálit zařazení pacienta do čekací listiny či transplantaci samotnou.
2. Lacienti s jaterní cirhózou funkční klasifikace Child-Pugh B a C (s dekompenzovanou jaterní cirhózou) představují bezinterferonové režimy optimální léčebnou strategii díky absenci nežádoucích účinků a vysoké šanci na dosažení SVR. Léčba má být vedena v transplantačních centrech nebo v centrech, která mají s protivirovou léčbou dekompenzovaných cirhotiků zkušenost.
V současné době stále zůstává otevřena otázka, zda pacienti s dekompenzovanou cirhózou, kteří jsou zároveň kandidáty transplantace jater, mají být léčení před transplantací nebo až časně po ní. Rozhodnutí je individuální a je ovlivněno zejména předpokládanou délkou doby v čekací listině v daném transplantačním centru a pokročilostí jaterní dysfunkce. Léčba u pacienta s dekompenzovanou jaterní cirhózou před Tx má dva základní cíle: prevenci reinfekce jaterního štěpu a zlepšení jaterní funkce. Potransplantační průběh bez HCV reinfekce je pak nekomplikovaný, zlepšení jaterní funkce před Tx s následným vyřazením z čekací listiny je zásadní zejména v situaci nedostatku vhodných jaterních štěpů k transplantaci. Problémem však zůstává načasování a délka protivirové léčby v čekací listině. U pacientů, kteří jsou z čekací listiny vyřazeni pro zlepšení jaterní funkce, musíme i po úspěšné léčbě počítat s rizikem další dekompenzace a vzniku HCC.
Léčba kombinací sofosbuviru s ribavirinem před transplantací byla první kombinací použitou jako prevence rekurence HCV v jaterním štěpu u pacientů s genotypem 1 a 4. V současné době je tato kombinace již opuštěna pro nízkou účinnost.
Léčba režimy obsahujícími proteázový inhibitor nemá být použita u pacientů s jaterní cirhózou funkční klasifikace Child Pugh B a C pro vysoké riziko nežádoucích účinků spojené s vyššími koncentracemi léků v krvi. Pacienti s dekompenzovanou jaterní cirhózou zařazení v čekací listině k transplantaci jater mají být léčení kombinací sofosbuviru a NS5A inhibitoru, tedy ledipasviru, daclatasviru či velpatasviru, ideálně bez použití ribavirinu. Účinnost léčby je však nižší než u pacientů s kompenzovanou cirhózou, riziko dekompenzace a nežádoucích účinků v průběhu léčby je vyšší u pacientů s MELD skóre ≥15. Pacienti s dekompenzovanou cirhózou a MELD skóre ≥18-20 mají být léčeni až po transplantaci jater.
16.3. Pacienti po transplantaci jater
Rekurence HCV infekce po Tx jater postihuje téměř všechny pacienty. Průběh infekce po Tx je akcelerován a přibližně u 1/3 pacientů se rozvine jaterní cirhóza během 5 let po Tx. V posledních letech se jasně prokázalo, že úspěšná protivirová léčba má velmi pozitivní vliv na přežití štěpu i pacienta.
Pacienti s potransplantační rekurencí HCV infekce jsou proto kandidáty protivirové léčby. Léčba má být zahájena urgentně u pacientů s fibrotizující cholestatickou hepatitidou a rovněž u pacientů s cirhózou štěpu a portální hypertenzí, neboť tito jsou nejvíce ohrožení ztrátou štěpu a úmrtím. V současné době jsou však kandidáty protivirové léčby všichni nemocní s prokázanou rekurencí HCV. Léčba po transplantaci má být zahájena časně, ideálně ihned po zvládnutí časných pooperačních komplikací.
16.4. Pacienti indikovaní k transplantaci jater
Dávka ribavirinu má být upravena individuálně dle renálních funkcí, u pacientů s cirhózou štěpu má být zahájeno podávání ribavirinu v dávce 600 mg denně a dávka upravena dle tolerance. Pacienti s kontraindikací podání ribavirinu mají být léčeni fixní kombinací sofosbuviru s ledipasvirem nebo velpatasvirem po dobu 24 týdnů.
17. Opakovaná léčba pacientů bez SVR
17.1. Po terapii PEG-IFN + RBV + telaprevir/boceprevir/simeprevir
Pacienti léčení v minulosti trojkombinací s použitím NS3/4A inhibitoru by měli být léčeni kombinací sofosbuviru a NS5A inhibitoru.
17.2. Po terapii čistě perorálním režimem DAA
Pacienti se selháním léčby kombinací DAA by měli být léčeni kombinací obsahující lék s vysokou bariérou rezsitenci – v současnosti jde o sofosbuvir – v kombinaci s 1-3 dalšími virostatiky, ideálně bez zkřížené rezistence s léky použitými v minulosti. Opakovaná léčba by měla obsahovat ribavirin a měla by trvat 12 týdnů. 24 týdnů by měla léčba trvat u pacientů s F3 nebo F4. Při kontraindikaci ribavirinu nebo při intoleranci ribavirinu by měla léčba trvat 24 týdnů i u méně pokročilého onemocnění.
18. Léčba pacientů s komorbiditami nebo akutní HCV infekcí
18.1. Koinfekce HBV/HCV
U naprosté většiny pacientů koinfikovaných HBV/HCV je hlavní příčinou jaterního onemocnění HCV, replikace HCV tlumí replikaci HBV, proto lze zpravidla v séru prokázat HCV RNA, zatímco sérová hladina HBV DNA je pod hranicí detekce. Z uvedeného vyplývá, že u těchto osob je zapotřebí stanovit replikační aktivitu obou virů, tj. stanovit sérové koncentrace HBV DNA i HCV RNA. Indikováno je i vyšetření sérologie HDV (případně i HEV RNA). Pokud je hlavním patogenetickým činitelem HCV, je třeba v případech koinfekce postupovat stejně jako u monoinfekce HCV. Po dosažení eliminace HCV je určité riziko reaktivace HBV. Pokud k této situaci dojde a objeví se významná replikace HBV, je indikováno zahájení léčby nukleotidovými analogy. Nukleotidová analoga jsou indikována jako součást protivirové léčby i v případě, že významná replikace HBV je přítomna i před zahájením protivirové léčby HCV infekce.
18.2. Osoby s extrahepatálními manifestacemi HCV infekce
Delší dobu je známa asociace HCV mnoha onemocněními autoimunitní povahy nebo povahy imunokomplexového orgánového postižení. Typickým zástupcem tohoto typu postižení je systémová vaskulitida s multiorgánovým postižením při smíšené kryoglobulinémii. Nepochybná je i asociace HCV infekce s B-buněčným non-Hodgkinským lymfomem (B-NHL). U většiny těchto extrahepatálních manifestací je v tuto chvíli prokazatelný přínos bezinterferonových režimů a dosažení SVR. Podle některých prací se zdá, že dosažení SVR12 může u HCV asociovaných B-NHL vést k jejich regresi. Při dosažení SVR dochází prokazatelně k ústupu a zlepšení klinických manifestací smíšené kryoglobulinémie.
18.3. Pacienti v pravidelném dialyzačním léčení
Pacienti zařazení do pravidelného dialyzačního léčení (PDL) představují velmi speciální skupinu nemocných s chronickou HCV infekcí. Základním kritériem pro zahájení protivirové léčby pacienta v PDL je perspektiva transplantace ledviny. V ostatních případech je třeba zcela individuální přístup, zvážení závažnosti jaterního postižení, celkové prognózy nemocného a především možných rizik vyplývajících z podání protivirové léčby. Léčba pacientů v PDL by měla být vedena na pracovišti majícím s touto skupinou nemocných zkušenosti.
HCV infekce je u pacientů v PDL asociována s vyšší všeobecnou i jaterní mortalitou. Hlavním faktorem limitujícím přežití těchto nemocných však zůstává kardiovaskulární morbidita.
V průběhu roku 2016 byla vydána níže uvedená společná doporučení ČHS ČLS JEP a České nefrologické společnosti pro diagnostiku a terapii HCV infekce.
18.3.1. Diagnostika HCV infekce u pacientů s onemocněním ledvin
Vyšetření anti-HCV je indikováno při zahájení dispenzarizace pacienta v nefrologické ambulanci, zejména při stadiu CKD (chronic kidney disease) 3b a vyšším, dále pak při zahájení programu náhrady funkce ledvin (pravidelná hemodialýza, peritoneální dialýza, příprava k transplantaci ledviny). Vyšetření anti-HCV má být následně prováděno alespoň 1x ročně, při nově vzniklé elevaci ALT nad dvojnásobek normy ihned, pak s odstupem 4 týdnů. Anti-HCV pozitivní, HCV RNA negativní pacienti s CKD mají mít jako screeningové vyšetření testováno HCV RNA 1x ročně.
Při zjištění anti-HCV pozitivity má být testována HCV RNA. V případě, že je pozitivní, má být pacient odeslán do specializované hepatologické či infekční ambulance, má být kvantitativně stanovena HCV RNA a vyšetřen genotyp a subtyp viru, posouzena jaterní funkce (jaterní enzymy, bilirubin, albumin, protrombinový čas). Metodou volby je nyní neinvazivní vyšetření pokročilosti jaterní fibrózy pomocí shear-wave či transientní elastografie, jaterní biopsie má být provedena pouze u vybraných případů k vyloučení jiné jaterní choroby, např. amyloidózy. Gastroskopie má být doplněna u pacientů s cirhózou s tuhostí jater nad 20 kPa k posouzení známek portální hypertenze.
Protivirová léčba má být zvážena u všech pacientů s CKD, s prokázanou HCV infekcí (akutní i chronickou). Interferonové režimy nejsou u pacientů léčených eliminační metodou (RRT) doporučeny ani v případě, že ještě nemají pokročilou fibrózu jater. Léčebný režim určuje hepatolog/infektolog na základě následujících parametrů: genotyp HCV, stupeň fibrózy, přidružená medikace, perspektiva transplantace ledviny. Praktický postup vyšetření anti-HCV pozitivního pacienta s CKD před zařazením do čekací listiny k transplantaci ledviny je uveden v obrázku 1.

18.3.2. Terapeutické možnosti
Použití ribavirinu u této populace je limitováno, dávkování je třeba individualizovat. Zprávy jsou o podávání ribavirinu 200 mg denně, 200 mg obden nebo 200 mg 3x týdně (vždy po hemodialýze).
Doporučení týkající se použití bezinterferonových režimů jsou následující:
Osoby s eGFR >30 ml/min/1,73 m2
18.4. Příjemci orgánových štěpů*
* kromě jater
HCV infikovaní příjemci transplantované ledviny jsou ohroženi rychlým průběhem jaterní fibrózy. HCV přitom negativně ovlivňuje přežití štěpu i pacienta. Přežití pacienta je ovlivněno i dalšími faktory asociovanými s HCV (HCV asociovanou glomerulonefritidou), ale i faktory bez vztahu k HCV. I v této skupině nemocných je hlavním limitujícím faktorem kardiovaskulární morbidita. Přítomnost jaterní cirhózy v okamžiku Tx ledviny je jedním z nejvýznamnějších negativních faktorů asociovaných se špatnou prognózou po Tx. Tito pacienti by měli být léčeni bezinterferonovými režimy.
V randomizované studii u pacientů po transplantaci ledviny byl studován režim SOF/LDV a SVR12 bylo dosaženo ve 100 % případů u pacientů léčených s HCV GT 1 po dobu 12 týdnů a HCV GT 4 po dobu 24 týdnů. Obě skupiny byly léčeny bez RBV. Studie z reálně praxe již reportují příznivá data o účinnosti mnoha různých bezinterferonových režimů u pacientů po transplantaci ledviny.
Data o HCV infekci u pacientů před nebo po transplantaci srdce jsou kontroverzní. Z možností protivirové léčby by měly být preferovány bezinterferonové režimy, zvážení rizik a přínosu je přísně individuální.
HCV infekce je považována v řadě center za kontraindikaci transplantace plic, perspektiva bezinterferonové léčby po transplantaci ale takovou kontraindikaci činí jen relativní.
18.5. Hemofilici
Charakteristiky HCV infekce u pacientů s různými typy hemofilií se nijak neliší od pacientů HCV pozitivních bez hemofilie. Metodou volby pro určení stádia jaterního postižení jsou v této skupině neinvazivní metody, v případech, kdy je indikováno měření portosystémového gradientu, lze provést současně i jaterní biopsii transjugulárním přístupem. Úmrtí z jaterních příčin patří v této skupině pacientů mezi nejčastější příčiny úmrtí. S výjimkou omezení pro jaterní biopsii je péče o HCV pozitivní hemofiliky stejná jako pro ostatní populaci. Nová DAA lze proto u této skupiny použít podle stejných pravidel.
18.6. Aktivní uživatelé drog
Drogová závislost je uvedena v Mezinárodní statistické klasifikaci nemocí a přidružených zdravotních problémů. Na pacienta drogově závislého je proto nutné pohlížet jako na člověka nemocného. Ani medicínsky ani eticky není tedy odůvodnitelné odmítnutí jakékoliv léčby uživatelům drog. Rozhodující je vždy zvážení přínosu a rizika pro individuálního pacienta.
Aktivní abusus alkoholu a drog negativně ovlivňuje adherenci k léčbě. Drogově závislí mají častější výskyt duševních poruch. To dále zhoršuje adherenci k terapii. Studie léčených pacientů s aktivní drogovou závislostí ukazují srovnatelný efekt terapie chronické HCV infekce s jinými skupinami infikovaných osob.
Zcela zásadní podmínkou pro zahájení terapie je motivace pacienta a jeho adherence k terapii. Předčasné ukončení terapie na základě špatné adherence je častější v prvních 12 týdnech. Kontrolou pomůcek a další intervencí lze u uživatelů drog snížit riziko reinfekce.
K léčbě musí být pacient motivován a musí spolupracovat, aby bylo možno snížit riziko rozvoje závažných nežádoucích účinků terapie. Tyto často souvisejí se současným užívání drog a kombinované protivirové terapie. Léčba drogově závislých je multifaktoriální a multioborová. Předpokládá zajištění psychiatrické intervence a sociálního šetření. Drogově závislý musí být před léčbou vyšetřen psychiatrem nebo lékařem pro léčbu závislostí. K uživatelům drog musí být vždy individuální přístup.
Pacienti na substituční léčbě jsou považováni za pacienty s kontrolovaným psychiatrickým onemocněním. Postup, diagnostika a terapie virové hepatitidy C u spolupracujícího pacienta, u pacienta s aktivní drogovou závislostí (nebo na substituční terapii), je shodný s doporučeným postupem u pacientů bez závislosti.
18.7. Akutní HCV infekce
Průběh akutní HCV infekce je ve většině případů asymptomatický, ale ke chronickému průběhu onemocnění dochází v 50-90 % případů. Symptomatický průběh, ženské pohlaví, nižší věk a genotyp IL28B CC jsou faktory asociované se spontánní eliminací viru. Žádný z těchto parametrů však nemá dostatečnou individuální prediktivní hodnotu. Pacienti s diagnostikovanou akutní hepatitidou C by měli být považováni za kandidáty protivirové léčby. Dosud byly publikovány malé studie s podáním SOF/LDV u akutní hepatitidy C vyvolané HCV GT 1, SVR12 byla 93 % (13/14) po 4 týdenní léčbě.
Ideální okamžik zahájení protivirové léčby nebyl u akutní HCV infekce definován. Někteří autoři považují za ideální okamžik k zahájení léčby okamžik vzniku elevace ALT, a to bez ohledu na přítomnost či absenci dalších klinických příznaků. Alternativou postupu je vyčkat do 12. týdne od vzniku příznaků a léčbu zahájit pouze u osob, které jsou i v tomto okamžiku HCV RNA pozitivní. Tento postup se jeví racionální především v symptomatických případech u osob s genotypem CC lokusu rs12979860 genu IL28B.
18.8. Pacienti s koinfekcí HCV + HIV
18.8.1. Základní fakta
Infekce HIV negativně ovlivňuje průběh akutní i chronické HCV infekce. Proto testování event. koinfekce HCV/HIV je standardní součástí vyšetřování pacientů s infekcí HCV. Jaterní choroby, zejména vzniklé v souvislosti s chronickou HCV infekcí, jsou v současnosti nejčastější příčinou úmrtí mezi HIV pozitivními pacienty. HIV/HCV koinfikované osoby mají většinou významně vyšší virémii nežli osoby infikované jenom HCV a především u nich dochází k mnohem rychlejšímu rozvoji fibrozy a cirhozy oproti HIV negativním jedincům.
18.8.2. Diagnóza HCV/HIV koinfekce
Všechny osoby HIV pozitivní by měly být vyšetřeny na HCV infekci. Zde je třeba myslet na skutečnost, že část osob s HIV infekcí (a především s nízkým počtem CD4 buněk) je anti-HCV negativní, nebo že titr anti-HCV je minimální a je proto neprokazatelný. U všech HIV pozitivních osob je tedy správné uvažovat vždy o vyšetření sérové HCV RNA metodou PCR. Všechny osoby HIV pozitivní, u kterých je sérová HCV RNA negativní (zejména u těch, které jsou přitom anti-HCV pozitivní), je třeba vyšetřovat opakovaně.
Pokročilost jaterního procesu se u HIV/HCV koinfikovaných posuzuje především neinvazivními metodami, stejně jako u osob monoinfikovaných HCV. Všem osobám HIV pozitivním by měla být doporučena vakcinace proti HBV (pokud jsou HBsAg a anti-HBs negativní) a vakcinace proti viru hepatitidy A (HAV). Samozřejmostí je minimalizace expozice všem ostatním hepatotoxickým vlivům (zejména alkoholu).
18.8.3. Terapie HCV/HIV koinfekce
Pravidla a varianty protivirové léčby chronické HCV infekce u HCV/HIV koinfikovaných osob se neliší od pacientů bez HIV koinfekce. Pozornost je třeba věnovat především lékovým interakcím mezi DAA a antiretrovirovými (AR) léky. Před zahájením bezinterferonové léčby infekce HCV je někdy nezbytné upravit AR terapii. Z hlediska lékových interakcí jsou z AR léků nejbezpečnější inhibitory integrázy. Naopak inhibitory proteázy by měl obsahovat jen jeden léčebný režim, buď AR nebo DAA. Je rovněž nevhodné kombinovat tenofovir (TDF) se SOF vzhledem ke vzájemné potenciaci nefrotoxicity. Při volbě vhodných AR a DAA režimů, podávaných současně, je žádoucí využití validovaného programu, který hodnotí riziko lékových interakcí a je dostupný na webových stránkách www.hep-druginteractions.org. Základní přehled možných interakcí terapeutických variant ukazuje tabulka 7.
U osob, u kterých i přes výše uvedené postupy dojde k progresi jaterní cirhózy, lze uvažovat o provedení jaterní transplantace. V ČR tuto indikaci nelze zatím považovat za standardní.
Tabulka 7: Přehled základních možných interakcí terapeutických variant HIV a HCV infekce
| Antivirotikum proti HIV | Antivirotikum proti VHC | |||||||
| SOF | SOF/LDV | SOF/VEL | 3D | GZR/EBR | DCV | SIM | ||
| nukleosidové inhibitory reverzní transkriptázy | abacavir | |||||||
| emtricitabin | ||||||||
| lamivudin | ||||||||
| tenofovir | x | x | ||||||
| nenukleosidové inhibitory reverzní transkriptázy | efavirenz | x | ! | ! | ! | x | ! | |
| etravirin | ! | ! | ! | x | ! | |||
| nevirapin | ! | ! | ! | x | ! | |||
| rilpivirin | x | |||||||
| inhibitory proteázy | atazanavir; atazanavir/r; atazanavir/cobicistat | x | ! | x | ! | |||
| darunavir/r; darunavir/cobicistat | x | ! | ! | |||||
| lopinavir/r | ! | ! | ! | |||||
| inhibitory integrázy a inhibitor vstupu | dolutegavir | |||||||
| elvitegravir/cobicistat/ emtricitabin/tenofovir disoproxil fumarat | x | x | ! | ! | x | ! | ||
| elvitegravir/cobicistat/ emtricitabin/tenofovir alafenamid | ! | ! | x | ! | ||||
| raltegravir | ||||||||
| maraviroc | x | |||||||
- žádné klinicky významné interakce nejsou předpokládány
x - kombinace vede k potenciálním interakcím, které mohou vyžadovat úpravu dávky, změnu podávání v čase nebo další monitoraci
! - tyto léky by neměly být podávány současně
19. Sledování pacientů neléčených a pacientů s neúspěšnou léčbou
Pacienti neléčení a pacienti s prodělanou neúspěšnou terapií (tj. bez SVR) by měli být dál pravidelně sledováni. Základním pravidlem má být zdokumentování důvodu nepodání protivirové léčby v daném okamžiku a případně typu protivirové odpovědi a pravděpodobného důvodu selhání léčby (zejména při suspekci na špatnou adherenci k léčbě). Neléčení pacienti by měli podstoupit kompletní vyšetření každých 12-24 měsíců, v intervalu 2 let může být provedeno i neinvazivní měření stadia jaterní fibrózy. Pacienti s jaterní cirhózou by měli absolvovat program surveillance HCC, tj. abdominální ultrasonografii každých 6 měsíců.
20. Vakcinace proti ostatním virovým infekcím jater
Všichni pacienti s chronickou HCV infekcí by měli být očkováni proti virové hepatitidě A. Séronegativní pacienti (tj. HBsAg, anti-HBc total a anti-HBs negativní) by měli být očkováni i proti virové hepatitidě B.
Použitá literatura
Zpět
Odborné dokumenty
Úvodní stránka
SIL © 25. 3. 2017